1、选择题 依据离子反应:1N2H5++4Fe3+===4Fe2++aY+……(a是配平后Y的系数),在水溶液中N2H5+将Fe3+还原为Fe2+,则N2H5+被氧化后的产物Y可能是?(?)
A.N2
B.H2
C.NH3
D.NO
参考答案:A
本题解析:略
本题难度:一般
2、选择题 对反应14CuSO4+5FeS2+12H?2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
A.该反应的氧化剂只有CuSO4
B.SO42-既不是氧化产物也不是还原产物
C.1 mol CuSO4还原了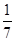 mol的S
mol的S
D.被还原的S和被氧化的S的质量比为7:3
参考答案:D
本题解析:A、根据方程式可知硫酸铜中铜元素的化合价从+2价降低到+1价,得到1个电子,硫酸铜是氧化剂。FeS2中S元素的化合价从-1价部分升高到+6价,失去7个电子,做还原剂。部分从-1价降低到-2价,做氧化剂,A不正确;B、部分SO42-是氧化产物,B不正确;C、硫酸铜是氧化剂,因此1 mol CuSO4氧化了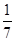 mol的S,C不正确;D、根据方程式和电子得失守恒可知,14mol硫酸铜氧化1mol FeS2。另外4mol FeS2中有3.5mol是氧化剂,0.5mol是还原剂,所以被还原的S和被氧化的S的质量比=3.5×2:(0.5×2+1×2)=7:3,D正确,答案选D。
mol的S,C不正确;D、根据方程式和电子得失守恒可知,14mol硫酸铜氧化1mol FeS2。另外4mol FeS2中有3.5mol是氧化剂,0.5mol是还原剂,所以被还原的S和被氧化的S的质量比=3.5×2:(0.5×2+1×2)=7:3,D正确,答案选D。
本题难度:一般
3、填空题 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
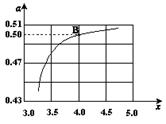
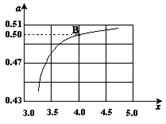
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)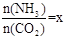 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl
参考答案:
本题解析:
本题难度:困难
4、实验题 (共12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- + H2O2 + H+ ="=" Mn2+ + O2 + ( )
(3)移取10mL过氧化氢溶液可以用_________________(填“酸式”或“碱式”)滴定管。不用碱式滴定管盛装KMnO4标准液的原因是 ,滴定到达终点的现象是__________ _____________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为_________________________________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果_________(填“偏高”或“偏低”或“不变”)。
参考答案:(1)容量瓶(1分)(2)2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+8H2O(分子式1分,配平2分,共3分)
(3)酸式 (1分) 高锰酸钾具有强氧化性,会使橡皮管老化 (2分)溶液由无色变为紫红色,且半分钟内不褪色(2分) (4) 2.5cv(2分) (5)偏高(2分)
本题解析:(1)准确配制一定体积一定物质的量浓的溶液用容量瓶,故答案为:容量瓶;(2)方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,先确定缺的是O2,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+8H2O。(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,故答案为:酸式;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。(4)根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用c mol/L KMnO4标准溶液V mL,即cV×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5cV×10-3mol。(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
考点:探究物质的组成或测量物质的含量;氧化还原反应方程式的配平
本题难度:一般
5、填空题 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2)? ?b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 ?d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)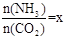 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl?――①? 3Cl2+8NH3→N2+6NH4Cl?――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→?――③
(5)反应③中的还原剂是?,还原产物是?。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是?mol。
参考答案:(1)<? a (共2分,各1分)
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大?(1分)
(3)25% (2分)?
(4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl?
(5)NH3(1分) NH4Cl 和HCl?(各0.5分,共1分)
(6)0.16?(2分)
本题解析:(1)由于合成氨的反应是可逆反应,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后不可能有4mol氨气生成,故放出的热量为Q<184.8kJ。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v逆(N2)=v正(H2) 相当于同一物质的正逆反应相等,正确;
(2)根据方程式,c(NH3)增大,平衡正向移动,所以CO2的转化率增大。
(3)图中的B点处,x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.5mol,依据化学方程式2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)反应的氨气为1mol,NH3的平衡转化率=1/4×100%=25%;故答案为:25%;
(4)运用氧化还原反应原理书写为2Cl2+15NH3=" 4" N2+ 7 NH4Cl + 17 HCl ,转移电子数为24e。
(5)反应③中的还原剂是NH3,还原产物是NH4Cl 和HCl。34.生成气体9.408L(标准状况),可求得其中氮气占了4/21,则被氧化的气体的物质的量就为氮气的8倍,即为0.16mol。
本题难度:困难