1、实验题 (16分)某同学为了研究乙酸的性质,进行了如下实验:
(一)该同学利用下图所示的仪器和药品,设计了一个简单的一次性完成实验装置,来验证乙酸、碳酸和苯酚溶液酸性强弱。
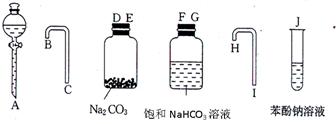
(1)实验装置的连接顺序是:A→?→?→?→ C →?→?→?→?→J
(2)写出实验中能说明碳酸比苯酚的酸性强的化学方程式 ?。
(二)为了研究乙酸的酯化反应,该同学进行了如下实验,步骤如下:在 园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装
园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装 通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)反应中浓硫酸做__________剂和吸水剂(或脱水剂)。
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是_________________。
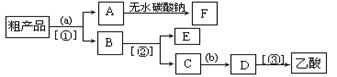
(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。若需要在图中圆括号内填入适当试剂,在方括号内填入适当分离方法。
 ?
?
下列试剂和分离方法正确的是 ?。
?。
A.试剂a是氢氧化钠溶液,试剂b是稀硫酸;分离方法①是蒸馏,分离方法②是分液,分离方法③是蒸馏
B.试剂a是饱和碳酸钠溶液,试剂b是稀硫酸;分离方法①是分液,分离方法②是蒸馏,分离方法③是蒸馏
C.试剂a是饱和碳酸钠溶液,试剂b是稀硝酸;分离方法①是过滤,分离方法②是分液,分离方法③是蒸馏
D.试剂a是氢氧化钠溶液,试剂b是盐酸;分离方法①是 分液,分离方法②是蒸馏,分离方法③是分液
分液,分离方法②是蒸馏,分离方法③是分液
(4)该同学在查阅资料时发现 ,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:
,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:

a.你认为其中属于加成反应的是?(填反应序号,在①②③④中选取)
b.在有机羧酸和醇的酯化反应中,脱水时,羧酸脱 ?基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是?。
?基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是?。
A.18O只能标记在醇羟基上
B. 18O只能标记在羧酸的羟基上
C.18O可以标记在醇羟基上,也可以标记在羧酸的羟基上
D.18O可以标记在醇羟基上,也可以标记在羧酸的羟基上,还可以标记在羧酸的羰基
上
参考答案:(一)(1)A→ D?→? E?→? B?→ C →? F → G?→? H →? I →J
(2分,错一个就记0分)
(2)CO2+H2O+C6H5ONa → C6H5OH+NaHCO3?(2分)
(二)(1)催化剂(2分)?(2)及时地蒸出生成物,有利于酯化反应向生成酯的方
向进行(2分)?(3)B (2分)(4)a.①④?(2分)? b.羟(2分)
A?(2分)
本题解析:略
本题难度:简单
2、选择题 研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是?
[?]
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢普通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
参考答案:C
本题解析:
本题难度:简单
3、实验题 (6分)下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
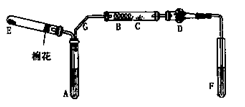
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号)?。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是?。
(3)写出B处的现象?。
参考答案:(6分)(1)B.E.A.F。(2)将试管A放入78℃的热水浴中。(3)铜丝的表面红色与黑色交替出现
本题解析:乙醇催化氧化的实验原理:2CH3CH2OH+O2Cu/Ag△2CH3CHO+2H2O;所以
(1)加热的仪器先后顺序为:B、E、A、F,实验时应先加热铜丝使温度升高,再通入氧气生成氧化铜,再加热A产生乙醇蒸气;
(2)由于无水乙醇和沸点78℃比水低,为产生平稳的气流,常用水浴加热的方法加热。
(3)铜丝表面现象将会出现红、黑交替现象。其实质铜做为催化剂作用。
本题难度:简单
4、简答题 在室温下,化学反应I-(aq)+OCl-(aq)=OI-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I-的初始浓度
(mol-L-1) | OCl-的初始浓度
(mol-L-1) | OH-的初始浓度
(mol-L-1) | 初始速率v
(mol-L-1-s-1)
1
2×10-3
1.5×10-3
1.00
1.8×10-4
2
a
1.5×10-3
1.00
3.6×10-4
3
2×10-3
3×10-3
2.00
1.8×10-4
4
4×10-3
3×10-3
1.00
7.2×10-4
|
已知表中初始反应速率与有关离子浓度关系可以表示为v=k[I-]1[OCl-]b[OH-]c(温?度一定时,k为常数)
①为了实施实验1,某同学取5mL0.02mol-L-1碘化钾溶液、5mL0.015mol-L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应.则该氢氧化钠溶液物质的量浓度为______?mol-L-1
②实验2中,a=______
③设计实验2和实验4的目的是______;
④计算b、c值:b=______;c=______
⑤若实验编号4的其它浓度不变,仅将溶液的OH-的初始浓度变为0.1mol-L-1,反应的初始速率v=______(mol-L-1-s-1).
参考答案:①将实验1数据代入公式v=k[I-]1[OCl-]b[OH-]c,可得1.8×10-4mol?L-1?s-1=K[0.002mol?L-1][0.0015mol?L-1]b[1mol?L-1]c设为A式,将实验4代入公式v=k[I-]1[OCl-]b[OH-]c,可得7.2×10-4mol?L-1?s-1=K[0.004mol?L-1][0.003mol?L-1]b[1mol?L-1]c设为B式,将AB两式联合组成方程组求解,可得,b=1,将b=1代入1.8×10-4mol?L-1?s-1=K[0.002mol?L-1][0.0015mol?L-1]b[1mol?L-1]c,可得K=60,将实验3数据代入公式v=k[I-]1[OCl-]b[OH-]c,可得1.8×10-4mol?L-1?s-1=K[0.002mol?L-1][0.003mol?L-1]b[1mol?L-1]c,将b=1,K=60,代入得C=-1,取5mL0.02mol?L-1碘化钾溶液、5mL0.015mol?L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应,溶液的总体积为50mL,则I-的初始浓度为C=nV=0.0001mol0.05L=0.002mol?L-1,OCl-的初始浓度C=nV=0.000075mol0.05L=0.0015mol?L-1,初始速率v=1.8×10-4mol?L-1?s-1,将数据代入公式v=k[I-]1[OCl-]b[OH-]c,可得1.81mol/L×0.05L0.04L10-4mol?L-1?s-1=K[0.002mol?L-1][0.0015mol?L-1]b[OH-]c,将b=1,K=60,C=-1,代入得[OH-]=1mol?L-1,原氢氧化钠溶液为40mL某浓度氢氧化钠溶液,所以原氢氧化钠溶液物质的量浓度为C=nv=1mol/L×0.05L0.04L=1.25mol?L-1,
故答案为:1.25;
②根据①的分析知:b=1,K=60,C=-1,联合实验数据2代入公式v=k[I-]1[OCl-]b[OH-]c,可得3.6×10-4mol?L-1?s-1=K[a]1[0.0015mol?L-1]1[1mol?L-1],可得a=4×10-3,
故答案为:4×10-3;
③根据①的解答,联合实验数据1和4求出b,对照实验2和实验4的数据的异同点,不同的数据有助于探究OCl-离子对反应速率的影响,
故答案为:探究OCl-离子对反应速率的影响;
④由①的解答知b=1,K=60,c=-1,故答案为:1;-1;
⑤将b=1,K=60,C=-1,代入得公式v=k[I-]1[OCl-]b[OH-]c,得v=60[I-]1[OCl-]b[OH-]-1,将OH-的初始浓度变为0.1mol?L-1,I-的初始浓度为4×10-3mol?L-1,OCl-的初始浓度为3×10-3mol?L-1,代入得反应的初始速率v=7.2×10-3mol?L-1?s-1,故答案为:7.2×10-3mol?L-1?s-1.
本题解析:
本题难度:一般
5、填空题 某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式? ?。
(2)实验室还可在? ?(填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(二)实验探究
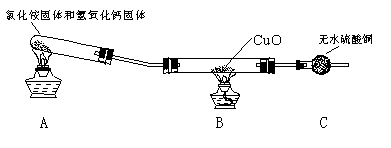
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是? ?。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式? ?
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:? ?
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。据此可推得A为?,由此得到的结论是?。
参考答案:(一)(1)2NH4Cl+Ca(OH)2? △?CaCl2+2NH3↑+2H2O?(2分)
(2)氢氧化钠固体(或生石灰或碱石灰)?(1分)
(二)(1)在装置A和B之间增加装有碱石灰的干燥管?(2分)
(2)3CuO+2NH3? △?3Cu+N2+3H2O?(2分)
(三)(1)取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有?(2分)
(2)Cu2O?(2分)? CuO比Cu2O的热稳定性差?(1分)
本题解析:本题综合考查了氨气的性质、对实验方案的评价和改进、实验方案的设计。
(一)实验室制氨气利用NH4++OH- NH3·H2O
NH3·H2O NH3↑+ H2O的平衡移动实现。故把浓氨水滴入碱石灰或是氢氧化钠固体中,吸水有利平衡正向移动,且放出的热也有利平衡正向移动。
NH3↑+ H2O的平衡移动实现。故把浓氨水滴入碱石灰或是氢氧化钠固体中,吸水有利平衡正向移动,且放出的热也有利平衡正向移动。
(二)无水硫酸铜在B后用来检验产物是否含水,但制的氨气未干燥故会产生干扰,所以要先干燥氨气再检验是否有水生成。
(三)实验设计的出发点还是物质性质上的差异。由题意可知,Cu2O可以和非氧化性的酸溶液反应,最终生成Cu2+和Cu。而红色的单质Cu则不能和非氧化性的酸溶液反应。所以利用非氧化性的酸(稀硫酸、盐酸),看是否有Cu2+生成来检验。
由产物颜色可以判断为Cu2O,说明高温下稳定好的才能最终存在。
本题难度:一般