1、实验题 (8分)某化学小组设计实验验证温度对化学反应速率的影响。
【实验用品】 溶液、
溶液、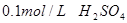 、烧杯、冷水、热水、秒表等
、烧杯、冷水、热水、秒表等
【实验步骤】
I.取两支试管各加入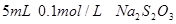 。
。
II. 另取两支试管各加入 。
。
III. ……
IV. 一段时间后,分别混合并搅拌。
V. 记录实验现象及数据。
(1)步骤III的操作为?。
(2)该实验需要记录的实验数据是?。
(3)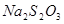 和
和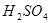 反应的化学方程式为?。
反应的化学方程式为?。
(4)能说明温度升高反应速率增大的现象是?。
参考答案:(8分)(每空2分)
(1)将四支试管分成两组(各有一支盛有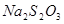 和
和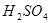 的试管),一组放入冷水中,另一组放入热水中。(一定要答出先分组浸泡,表述合理即可得分。若答为先混合,再分组浸泡不得分)
的试管),一组放入冷水中,另一组放入热水中。(一定要答出先分组浸泡,表述合理即可得分。若答为先混合,再分组浸泡不得分)
(2)出现浑浊的时间
(3)
(4)放入热水中的一组先出现浑浊
本题解析:(1)要验证温度对反应速率的影响,则需要进行对比实验,因此步骤Ⅲ是将四支试管分成两组(各有一支盛有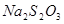 和
和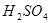 的试管),一组放入冷水中,另一组放入热水中。
的试管),一组放入冷水中,另一组放入热水中。
(2)由于反应中会产生单质硫沉淀,所以需要记录的实验数据是溶液出现混浊的时间。
(3)在酸性溶液中,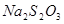 发生自身的氧化还原反应生成单质硫、SO2和水,方程式为
发生自身的氧化还原反应生成单质硫、SO2和水,方程式为 。
。
(4)温度高反应速率就快,所以出现混浊的时间就少。
本题难度:一般
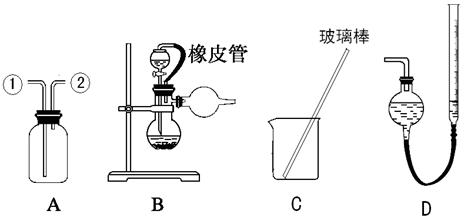
2、实验题 (16分) 某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验

 【实验一】收集NO气体。
【实验一】收集NO气体。
 (1)用装置A收集NO气体,正确的操作是?(填序号)。
(1)用装置A收集NO气体,正确的操作是?(填序号)。
 a.从①口进气,用排水法集气? b.从①口进气,用排气法集气
a.从①口进气,用排水法集气? b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气? d..从②口进气,用排气法集气
c.从②口进气,用排水法集气? d..从②口进气,用排气法集气
 【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
(2)请参照装置A,画出净化Cl2装置图,标明所盛的药品,标注气体的流动方向。
【实验三】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑ 据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用NaOH溶液作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
(3) 选用?和?(填仪器标号)两个装置进行实验。
选用?和?(填仪器标号)两个装置进行实验。
(4) 测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=?。
测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=?。
(5) 计算镀层厚度,还需要检索的一个物理量是?。
计算镀层厚度,还需要检索的一个物理量是?。
(6) 若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将?(填“偏大”、“偏小”或“无影响”)。
若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将?(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g ;
;
(7)w(Zn)=?。
参考答案:(1)C?
(2)(4分)
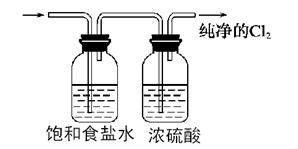
标注:饱和食盐水、浓硫酸、气流各1分,图中的导管的长短1分
(3)B和D?(各1分)(4)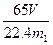 (或
(或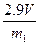 等其他合理答案:)
等其他合理答案:)
(5)金属锌的密度(或其他合理答案:)
(6)偏大
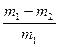 (或其他合理答案:)
(或其他合理答案:)
本题解析:略
本题难度:一般
3、填空题 (10分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
一、初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)用?(填实验用品名称)取固体混合物于烧杯中。
(2)上述实验可以得到的初步结论是?。
二、进一步探究
(3)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
实验操作
| 预期现象和结论
|
?
| ?
|
?
| ?
参考答案:
(1)药匙(1分)
(2)该混合物中肯定含有NH4HCO3(1分),肯定不含有CuSO4(1分)
(3)
实验操作
预期现象和结论
向溶液B中滴加少量Ba(NO3)2溶液。(1分)
如果产生白色沉淀,说明原固体混合物中含有K2SO4;(1分)
如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。)
(1分)
取少量原固体混合物于试管底部,(1分)?将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。(1分)
如果试管底部有固体残留,说明混合物中含有NaCl;(1分)
如果试管底部无固体残留,说明混合物中含有NH4Cl;(1分)
其他答案合理亦可。
本题解析:(1)用药匙取固体混合物于烧杯中。
(2)固体物质加水溶解,得到无色透明溶液,肯定不含Cu2+,闻到有轻微的刺激性气味,说明含有NH4+,再滴加稀硝酸,有气泡产生,说明生成了CO2,由此可以得到的初步结论是混合物中肯定含有NH4HCO3,肯定不含有CuSO4。
(3)
实验操作
预期现象和结论
向溶液B中滴加少量Ba(NO3)2溶液。
如果产生白色沉淀,说明原固体混合物中含有K2SO4;
如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。)
取少量原固体混合物于试管底部,(1分)?将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。
如果试管底部有固体残留,说明混合物中含有NaCl;
如果试管底部无固体残留,说明混合物中含有NH4Cl;
本题难度:简单
4、选择题 关于实验下列说法错误的是(?)
A.在硫酸铜晶体结晶水含量的 测定实验中,加热后的硫酸铜应在空气中冷却后 测定实验中,加热后的硫酸铜应在空气中冷却后 再称量 再称量
B.在中和热的测定实验中,应用稀的强酸和强碱作为反应物进行实验
C.在Fe(OH)3胶体的电泳实验中,靠近阴极附近的液体的颜色会加深
D.在硫酸铜晶体结晶水含量的测定实验中,加热不够充分将会使实验结果偏小
参考答案:A
本题解析:
本题难度:简单
5、实验题 在进行某实验探究过程中,一些学生发现等质量的铜片分别与等体积(均过量)的浓硝酸和稀硝酸反应,所得溶液前者为绿色,后者为蓝色。
针对这种现象,学生们进行了讨论后,出现了以下两种观点:
一种认为,这可能是Cu2+浓度的差异引起的。你同意这种看法吗??(填“同意”或“不同意”),原因是?。
另一种认为,呈“绿色”是Cu2+与NO2混合的结果。请你设计出一个实验方案证明之,你设计的实验方案是??
已知0.3mol Cu与足量的稀硝酸反应,则被还原的HNO3的物质的量是?mol。
参考答案:不同意(1分)?浓硝酸、稀硝酸均过量,Cu全部转化为Cu2+,则在同体积的溶液中Cu2+浓度相同、溶液颜 色应该相同(2分)
加水稀释看能否由绿色变为蓝色(2分,其它合理答案均可)
0.2mol(2分)
本题解析:因溶液的颜色由有色离子的浓度来决定,而Cu2+浓度相同,颜色应该相同,故答案为:不同意; 浓硝酸、稀硝酸均过量,Cu全部转化为Cu2+,则在同体积的溶液中Cu2+浓度相同、溶液颜色应该相同。
因除去NO2若颜色变蓝,则是由于Cu2+与NO2混合的结果,故答案为:加水稀释看能否由绿色变为蓝色。
Cu与足量的稀硝酸反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O,在这个方程式中我们可以知道有2mol硝酸被还原成NO,参加反应的硝酸与被还原的硝酸的物质的量之比是4:1,而0.3molCu和0.8molHNO3完全反应,所以硝酸物质的量为0.8mol,则被还原的HNO3物质的量是0.2mol。
点评:本题主要考查了铜与硝酸的反应,根据问题情景,运用所学知识来解决问题,培养了学生分析问题解决问题的能力,题目难度中等。
本题难度:一般
|