1、简答题 (1)某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
①据图1写出A中有机反应的化学方程式______
②已知上述有机反应是放热反应.观察到A中的现象是______及______.
③实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______,写出有关的化学方程式______.
④C中盛放CCl4的作用是______.
⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明.另一种验证的方法是向试管D中加入______,现象是______.
(2)图2是乙炔的实验室制法
①反应原理______.
②选择合适的制取实验装置______.
③实验中常用饱和食盐水代替水,目的是______.
④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味.可以用______溶液除去杂质气体.

参考答案:(1)①在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,故答案为:C6H6+Br2Fe
本题解析:
本题难度:一般
2、选择题 下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子
B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+?存在
D.某溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+
参考答案:A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,可能含硫酸根离子或银离子,但二者不能同时存在,故A错误;
B.将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,为避免钠的黄光的影响,则透过蓝色钴玻璃进行观察K的焰色,故B正确;
C.因铵盐与碱反应生成氨气,氨气使湿润的红色石蕊试纸变蓝,则待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在,故C正确;
D.铁离子遇KSCN溶液变血红色,则溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+,故D正确;
故选A.
本题解析:
本题难度:简单
3、实验题 (16分)
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
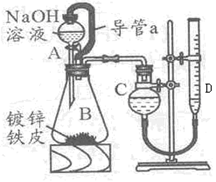
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。
回答下列问题 :
(1)仪器名称A??_B??
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D?(具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后?,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为?。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液?。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:

参考答案:(1)分液漏斗,锥形瓶
(2)将AB连通,平衡两者气压,使液体能顺利流下
(3)C中液面与D中液面相平;C中液面与D中液面相平;保证BC装置内的气压始终恒定。
(4)2Al + 2OH— + 2H2O = 2AlO2— + 3H2↑
(5)参考方案:取B 反应后剩余液,加入足量稀硝酸酸化,再滴入KSCN溶液,未见变红(其他方案合理亦可)
(6) h=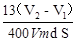
(7) 参考1:镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算
参考2:镀锌铁皮与盐酸反应后,根据金属的质量及产生氢气的体积进行换算
参考3:镀锌铁皮与盐酸反应后,在余下液体中加入足量强碱,过滤洗涤灼烧根据产生的氧化铁质量换算
(其他方案:在中学生所知范围内,合理即可)
本题解析:(1)在做制备氯气的实验中用过这些一起,A为分液漏斗。B为锥形瓶。(2)为了使反应顺利进行,反应漏斗的试剂顺利滴下,需要保持压强的内外一致,因此需要导管a这个装置,装置中导管 a 的作用是:将AB连通,平衡两者气压,使液体能顺利流下。(3)本实验的关键是测量气体的体积。根据此装置的原理,应两次记录C中的读数,取其差值就是所得气体的体积,因此干燥管C与量气管D(具有刻度的细长玻璃管)在反应前后液面高度都是相平的。(4)根据所学知识,铝可与强碱溶液反应,离子方程式为:2Al + 2OH— + 2H2O = 2AlO2— + 3H2↑。(5)利用铁离子(Fe3+)的特征反应,遇KSCN溶液变红来检验铁是否参与了反应,方案为:取B 反应后剩余液,加入足量稀硝酸酸化,再滴入KSCN溶液,未见变红(其他方案合理亦可)。(6)根据体积只差算出放出H2的体积,利用化学方程式:Zn+20H-=Zn022-+H2↑,计算出Zn的质量,再用m=ρV=ρSh,得出h=m/(ρS),带入数据,解得h=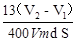 。(7)这题是开放题,只要符合题意的方案都是可以的。
。(7)这题是开放题,只要符合题意的方案都是可以的。
点评:本题考查的是化学实验的基本操作及相关计算,测重基本实验操作能力考查。化学计算注重解题技巧,尤其是最后一题考查思维的深刻性和灵活性。
本题难度:一般
4、选择题 下述实验设计能够达到目的的是(?)
编号
| 实验目的
| 实验设计
|
A
| 证明盐酸酸性比醋酸强
| 用同一电路测等体积的盐酸、醋酸溶液的导电性
|
B
| 证明H2CO3酸性比H2SiO3强
| 将CO2通入Na2SiO3溶液中
|
C
| 证明钠的金属活动性比铜强
| 向CuCl2溶液中投入金属钠
|
D
| 证明溶液中含有I-
| 向溶液中加入淀粉
|
?
参考答案:B
本题解析:通过导电性比较盐酸和醋酸的酸性强弱,必须使用相同浓度的盐酸和醋酸溶液,A错误。金属钠投入CuCl2溶液中,钠与水反应生成NaOH,NaOH与Cu2+反应生成Cu(OH)2金属钠不能从CuCl2溶液中置换出铜,不能比较金属活动性的强弱,C错误。淀粉只能检验出碘单质,D错误。
本题难度:一般
5、实验题 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、?、?等。
②称量?g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、?。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用?(填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
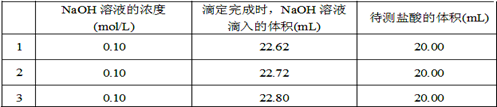
①滴定达到终点的标志是?。
②根据上述数据,可计算出该盐酸的浓度约为?(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的?,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
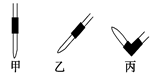
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有?。
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体