1、简答题 (15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
操作
| 现象
|
 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。
| ?
|
b.把小块烧红的木炭迅速伸入热的浓硝酸中。
| 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。
|
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有?性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是?。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
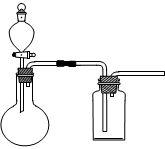
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。

② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式?。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式?。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验?。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由?。
参考答案:(15分,画图3分,其他每空2分)
(1)① 强氧化性?② O2
(2)Ⅰ①
两处导气管进出长短对各1分,漏斗对1分)
② 2NO2 + 2NaOH  ?NaNO2 + NaNO3 + H2O(物质1分,配平1分)
?NaNO2 + NaNO3 + H2O(物质1分,配平1分)
Ⅱ① 2NO2 + 2C点燃 N2 + 2CO2(物质1分,配平1分)
② 当木炭燃烧时,体系中氧气浓度低于空气中氧气浓度,所以不用补充木炭在纯氧
中燃烧的实验。(按要求给分)
③ 主要是和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体均存在。(按要求给分)
本题解析:(1)①碳与浓硝酸的反应,说明浓硝酸具有强氧化性;
② 根据氧化还原反应中元素的化合价有升有降的原则,红棕色气体是二氧化氮,N元素的化合价降低,而H元素的化合价已是最高,不能再升,所以只能是O元素的化合价升高,因此,无色气体X是O2;
(2)Ⅰ①铜与浓硝酸制取二氧化氮不需加热,用烧瓶和分液漏斗即可,二氧化氮的密度大于空气,所以用向上排气法收集NO2,导气管长进短出,装置如图

②NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,则两种盐分别是硝酸钠和亚硝酸钠,化学方程式为2NO2 + 2NaOH  ?NaNO2 + NaNO3 + H2O;
?NaNO2 + NaNO3 + H2O;
Ⅱ. ①木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,说明碳与NO2气体反应生成二氧化碳和无色气体氮气,化学方程式为
2NO2 + 2C点燃 N2 + 2CO2
②当木炭燃烧时,体系中氧气浓度肯定低于空气中氧气浓度,实验现象说明火焰迅速变亮,不是碳与氧气反应的结果,所以不用补充木炭在纯氧中燃烧的实验。
③木炭所处的环境是二氧化氮的浓度大于氧气的浓度,所以出现火焰迅速变亮的现象主要是木炭和NO2的燃烧反应,也会发生与氧气的燃烧反应,因为两种气体均存在。
本题难度:一般
2、实验题 某学生课外活动小组利用下图所示装置分别做如下实验

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后? 恢复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,? 则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是_______________________________________________________________。
参考答案:(1)稀氨水和酚酞;稀氨水中的NH3气逸出,所以溶液的颜色变浅
(2)溶有SO2的品红?;SO2气体逸出,品红溶液恢复红色
本题解析:
本题难度:一般
3、填空题 (9分)实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为: 2NH3+3CuO
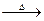 N2+3Cu+3H2O
N2+3Cu+3H2O
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
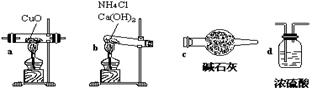
①仪器连接的顺序(用字母编号表示,仪器可重复使用)?;d中浓硫酸的作用是?,?;实验完毕时观察到a中的现象是?;
②列出计算Cu的相对原子质量的表达式?;
③下列情况将使测定结果偏大的是?。(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu? (b)CuO受潮? (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有?
(a)m(Cu)和m(CuO) ?(b)m(N2)和m(H2O) ?(c)m(Cu)和m(H2O) ?(d)m(NH3)和m(H2O)
参考答案:(1)①b c a c d?吸收未反应的氨 ?防止空气中水分进入 ?固体由黑色转变为红色?②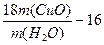 ?③a、c?(2)a、c
?③a、c?(2)a、c
本题解析:根据本题的意图是需要测定反应物氧化铜和生成物水的质量,从而利用氨和加热条件下的氧化铜在化学反应中的关系求出铜的相对原子质量。氧化铜的质量可直接从所取的药品称量中得知,测反应生成的水的质量时,应考虑制得的氨气中混有的水蒸气对测量有干扰作用,应予以排除,反应后的气体中必然夹杂着未反应完的氨气,吸收水蒸气时也要考虑不能用浓硫酸作吸收剂,否则会同时吸入水蒸气和氨气,造成测量数据偏大。
(1)①NH4Cl和Ca(OH)2反应可生成NH3,经碱石灰干燥后(不能用浓H2SO4干燥),因为浓H2SO4要吸收NH3)把NH3通入a装置发生主体反应,将反应后生成的水蒸气用C吸收(不能用浓H2SO4吸收),因为还有未反应的NH3也可被浓H2SO4吸收,这样测量水的质量就偏大,多余的NH3用浓H2SO4吸收,同时也防止空气中的水蒸气进入第二个C装置中。
②2NH3+3CuO=N2+3Cu+3H2O(设铜的相对原子质量为x)
3(x+16)? 3×18
m(CuO)? m(H2O)? x="18" m(CuO)/ m(H2O)-16
或考虑计算铜的相对原子质量的思路是:
n(CuO)=m(H2O)/18? M(CuO)=m(CuO)/n(H2O)=18m(CuO)/m(H2O)? M(Cu)=M(CuO)-16如果测量反应前后硬质玻璃管的质量,则可测出反应生成的铜的质量,从测得的氧化铜的质量可计算铜的相对原子质量为:
M(Cu)=m(Cu)/n(CuO)=18m(Cu)/m(H2O)。
从测得的生成的水的质量,也可计算铜的相对原子质量为:
M(Cu)=m(Cu)/n(H2O)=18m(Cu)/m(H2O)。
③要使测定结果偏大,则m(H2O)m要偏小,其中(a)导致m(H2O)偏小?(b)导致m(H2O)偏大?(c)相当于m(H2O)偏小。故选a、c。
(2)由于气体的质量难于测量,也难于收集,所以(b)(d)是不可选用的。
本题难度:简单
4、选择题 同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中水面上升的高度分别为h1、h2、h3,则下列关系正确的是(?)
A.h1>h2>h3
B.h1>h3>h2
C.h2>h3>h1
D.h3>h1>h2
参考答案:C
本题解析:设试管的容积是V。①中的反应是3NO2+H2O=2HNO3+NO,剩余的气体是V/2+V/6=2V/3,则溶液的体积是V/3。②中的反应是4NO2+O2+2H2O=4HNO3,剩余的气体是V/2-V/8=3V/8,则溶液的体积是5V/8。氨气极易溶于水,剩余在试管③中溶液的体积是V/2。所以正确的答案是C。
本题难度:简单
5、选择题 有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是
[? ]
A.氨气极易溶解于水的性质可以解释氨气的喷泉实验?
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D.NH3·H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
参考答案:AD
本题解析:
本题难度:简单