1、选择题 向某溶液中通入NO2,一段时间后,在该溶液中一定能大量共存的离子组是
A.Na+、H+、SO42-、I-
B.Na+、Ca2+、CO32-、Al3+
C.Na+、K+、Fe2+、H+
D.K+、SO42-、Cl-、H+
参考答案:D
本题解析:正确解法:NO2会与水发生氧化还原反应生成HNO3.A选项中的I-会被HNO3氧化成I2.B选项中的Ca2+与CO32-会生成难溶物,一定不能大量共存.
C选项中的Fe2+具有还原性,会被HNO3氧化.D选项中的离子在题设条件下能够大量共存.
点评:同学们在解题时如果遇到“NO3-”,就要看题目的条件中是否隐含了酸性条件,再看离子间能否发生氧化还原反应.
本题难度:困难
2、实验题 如下图是课外活动小组同学设计的几种尾气吸收装置。从实验安全和保护环境的角度考虑,当用于吸收HCl气体时(装置中液体为水,固体为碱石灰),应选用的装置是______________(选填装置序号)。若用于吸收NH3,在上述已选用的装置中不宜采用的是______________,原因是____________________________________________;若用于吸收Cl2制取氯水,应选用的装置是_______________。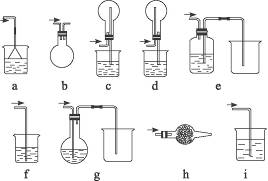
参考答案:a、d、e、h? h? NH3是碱性气体,不能用碱性的碱石灰吸收? g
本题解析:吸收HCl时,a,d有足够的空间,不至于引起倒吸,e不与水接触,也不至于倒吸,h中的碱石灰与酸性HCl气体反应而吸收HCl气体;制氯水时,Cl2必须通入水中,且需吸收尾气防止污染,只能选g装置。
本题难度:简单
3、选择题 某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂挂在铁架台上,另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
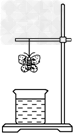
[? ]
纸蝴蝶上的喷洒液
小烧杯中的溶液
A.
酚酞
浓氨水
B.
石蕊
浓盐酸
C.
酚酞
氢氧化钠溶液?
D.
石蕊
浓硫酸
参考答案:A
本题解析:
本题难度:简单
4、选择题 已知2NO2 + H2O = HNO3 + HNO2,结合已有知识推断,下列结论正确的是…( )
①HNO2比HNO3更不稳定;②HNO2的分解产物为NO和H2O;③HNO2的分解产物为NO2、NO和H2O。
A.只有①
B.①②
C.①③
D.②③
参考答案:C
本题解析:①HNO2的酸酐是N2O;②HNO2在低温时稳定;③HNO2有还原性,也有氧化性,有毒。
本题难度:简单
5、计算题 磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是______________,其相应的质量为________。
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热ΔH=________。
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式:________________。
命题意图:本题以磷为载体,考查燃烧热、盖斯定律及热化学方程式的有关知识,重点是考查燃烧热定义和盖斯定律的理解和应用,而涉及磷的知识并不复杂。
参考答案:(1)P2O3和P2O5? 2.75 g和3.55 g
(2)-(20X-Y) kJ·mol-1
(3)P(s)+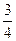 O2(g)====
O2(g)====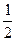 P2O3(s);ΔH="-(20X-Y)" kJ·mol-1
P2O3(s);ΔH="-(20X-Y)" kJ·mol-1
本题解析:(1)由题意得生成的两种氧化物分别为P2O3和P2O5,设生成P2O3和P2O5需P的物质的量分别为x、y,根据反应方程式:4P+3O2====2P2O3和4P+5O2====2P2O5得
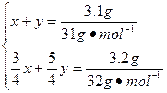
解得x=y=0.05 mol。
(2)由燃烧热的定义,推出0.05 mol磷单质完全燃烧放出的热量为0.05 Y kJ,则生成P2O3时放出的热量为(X-0.05Y)kJ,从而推出1 mol磷单质燃烧生成P2O3时放出的热量为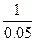 (X-0.05Y)kJ,即(20X-Y)kJ。
(X-0.05Y)kJ,即(20X-Y)kJ。
本题难度:简单