1、实验题 某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。回答下列问题:

(1)正确的操作顺序是:B、?、F(填序号);
(2)上述B步骤操作的目的是?;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响?
是??(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是?;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为?mL。
(6)根据读数计算出该待测液的浓度为?。
2、填空题 (12分)已知固体草酸(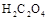 )分解的化学方程式为:
)分解的化学方程式为:
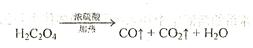
某实验小组为测定铁锈样品的组成(假定铁锈中只有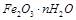 和
和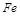 两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
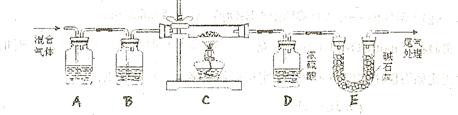
(1)为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次是?、?(填答案编号)a.浓硫酸? b.澄清的石灰水? c.氢氧化钠溶液? d.氯化钙溶液
(2)在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;
(b)??;
(3)E装置的作用是?。
上述装置最后尾气处理的方法是?:
(4)准确称量样品质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=?.
(5)在本实验中,下列情况会使测定结果n偏大的是?(填答案编号)
a.缺少装置B? b.缺少装置E? c.反应后的固体剩余少量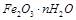
3、选择题 用NaOH固体配制1 mol/L NaOH溶液,在下列仪器中要用到的是?①托盘天平;②量筒;③容量瓶;④滤纸;⑤烧杯;⑥玻璃棒;⑦酒精灯;⑧试管;⑨胶头滴管
A.①③④⑤⑥⑦⑧
B.②③⑤⑥⑦⑧⑨
C.①②③⑤⑥⑦⑨
D.①②③④⑤⑥⑨
4、实验题 S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种:
 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: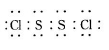 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:

实验室利用下列装置制备 (部分夹持仪器已略去):
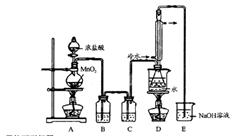
回答下列问题:
(1)写出A装置中发生反应的离子方程式??
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是?
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中?实验。
A.石油分馏
B.制备乙烯
C.制取乙酸乙酯
D.制取溴苯