1、实验题 某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。回答下列问题:

(1)正确的操作顺序是:B、?、F(填序号);
(2)上述B步骤操作的目的是?;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响?
是??(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是?;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为?mL。
(6)根据读数计算出该待测液的浓度为?。
参考答案:(1)D C E A?(2)防止滴定管内壁附着的水将标准溶液稀释而带来误差
(3)偏大?(4)溶液由无色变为浅红色,且半分钟内不褪色
(5)21.10?(6)0.09000mol·L-1
本题解析:(1)用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液时,其正确的操作为用标准氢氧化钠溶液润洗滴定管2-3次,取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处,把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液,调节液面至“0”或“0”刻度以下,记下读数,为3.10mL,取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液,把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。所以答案为D C E A;(2)中,B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差;(3)中,若先用待测溶液润洗锥形瓶,则会使测定结果偏大;(4)中,到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色;(5)中,终点读数为21.10,注意小数点的精确位数;(6)中,根据cv=c1v1
可以得到,0.1000×(21.10-3.10)=20c1,解得c1为0.09000mol·L-1。
点评:该题考查了如何配置溶液以及酸碱滴定的相关知识,难度不大,解答该题要注意仪器的读数所精确的位数。
本题难度:一般
2、填空题 (12分)已知固体草酸(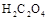 )分解的化学方程式为:
)分解的化学方程式为:
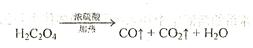
某实验小组为测定铁锈样品的组成(假定铁锈中只有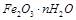 和
和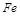 两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
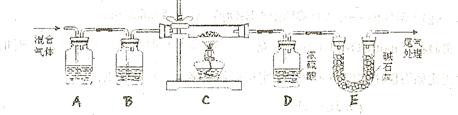
(1)为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次是?、?(填答案编号)a.浓硫酸? b.澄清的石灰水? c.氢氧化钠溶液? d.氯化钙溶液
(2)在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;
(b)??;
(3)E装置的作用是?。
上述装置最后尾气处理的方法是?:
(4)准确称量样品质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=?.
(5)在本实验中,下列情况会使测定结果n偏大的是?(填答案编号)
a.缺少装置B? b.缺少装置E? c.反应后的固体剩余少量
参考答案:

本题解析:(1)混合气体的主要成分为: ?、
?、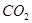 、
、 ,得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次是氢氧化钠溶液除去二氧化碳气体,浓硫酸除去水蒸气;
,得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次是氢氧化钠溶液除去二氧化碳气体,浓硫酸除去水蒸气;
(2)CO气体为可燃性气体,为防止加热时产生爆炸,加热前应通入混合气体一段时间,排净体系中的空气,再加热;
(3)装置E的作用是吸收生成的二氧化碳气体,同时防止空气中的水蒸气进入体系,影响实验结果;最后尾气处理的方法是:在装置后放一燃着的酒精灯;
(4)反应结束后,固体质量减少为10.00—8.32=1.68g;D中浓硫酸增重0.72g,即含水蒸气为0.72g;样品中氧化铁中的氧元素的质量为:1.68—0.72=0.96g;CO与其关系为
CO~O~CO2,即生成的二氧化碳的物质的量为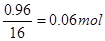 ;则由方程式:
;则由方程式:
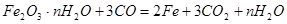
3mol? 18n g
0.06mol? 0.72g
解得n=2;
(5)ab
本题难度:一般
3、选择题 用NaOH固体配制1 mol/L NaOH溶液,在下列仪器中要用到的是?①托盘天平;②量筒;③容量瓶;④滤纸;⑤烧杯;⑥玻璃棒;⑦酒精灯;⑧试管;⑨胶头滴管
A.①③④⑤⑥⑦⑧
B.②③⑤⑥⑦⑧⑨
C.①②③⑤⑥⑦⑨
D.①②③④⑤⑥⑨
参考答案:D
本题解析:根据溶液配制的步骤:一算(计算)、二称(称量)、三溶(溶解)、四转(转移)、五洗(洗涤)、六定(定容)、七摇(摇匀)、八装(装瓶)、九贴(贴标签)。需要用到托盘天平、量筒、容量瓶、滤纸、烧杯、玻璃棒、胶头滴管
点评:属于较简单题。
本题难度:一般
4、实验题 S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种:
 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: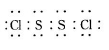 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:

实验室利用下列装置制备 (部分夹持仪器已略去):
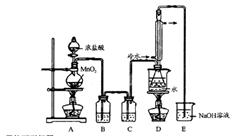
回答下列问题:
(1)写出A装置中发生反应的离子方程式??
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是?
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中?实验。
A.石油分馏
B.制备乙烯
C.制取乙酸乙酯
D.制取溴苯