1、选择题 氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会(? )。
A.偏低l%
B.偏高1%
C.无影响
D.偏高0.1%
参考答案:C
本题解析:因为不论是氢氧化钠还是碳酸钠和盐酸反应的最终产物都是氯化钠,虽然碳酸钠还生成二氧化碳,但由于甲基橙的变色范围是3.1~4.4,所以根据钠离子守恒可知,消耗的盐酸是相同的,因此对测定结果是无影响的。答案选C
本题难度:简单
2、选择题 如下图装置可用于
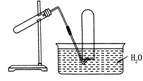
A.加热NaHCO3制CO2
B.加热NaCl固体与浓硫酸反应制HCl
C.用高锰酸钾加热制取O2
D.用Cu与稀硝酸反应制NO
参考答案:C
本题解析:该装置中可以看出,反应装置为固液或液液反应,收集装置为排水法收集。A、固体加热需向下倾斜,B、不能使用排水法收集,C、固固加热向下倾斜,答案选D。
本题难度:一般
3、选择题 实验是化学研究的基础,关于下列各装置图的叙述正确的是
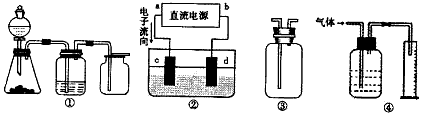
[? ]
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
参考答案:C
本题解析:
本题难度:一般
4、实验题 (14分)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。

I.(1)A中制取乙炔的化学反应方程式为?:?。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是??;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用??(填序号,下同)装置,
气体应从?进;干燥乙炔最好选用?装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
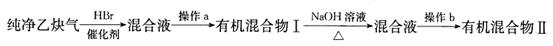
(1)操作b的名称是??;
(2)有机混合物I可能含有的物质是?(写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为???;
参考答案:(1)CaC2+2H2O→C2H2↑+Ca(OH)2(2分)
(2)控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管(2分)
(3)C(1分)d(1分)D(1分)
II.(1)分馏(或蒸馏)(2分)
(2)CH2===CHBr(1分)CH3—CHBr2(1分)CH2Br—CH2Br(1分)
(3)CH3CHO(2分)
本题解析:I.电石与水反应即生成乙炔,方程式为:CaC2+2H2O→C2H2↑+Ca(OH)2。由于电石与水反应很剧烈,所以必须控制反应速率,故使水缓慢滴下。H2S、PH3等具有还原性可以利用CuSO4除去,除杂时应是长口进,短口出。碱石灰的干燥能力强于氯化钙的,故选择碱石灰。
Ⅱ.乙炔与溴化氢加成产物是溴代烃,溴代烃不溶于水可以通过分馏或蒸馏。若乙炔与溴化氢1︰1加成,产物是CH2=CHBr;若乙炔与溴化氢1︰2加成,产物可以是CH3—CHBr2或CH2Br—CH2Br。含有2个碳的饱和一元醛只能是乙醛,结构简式为:CH3CHO。
本题难度:一般
5、填空题 (7分)已知“84消毒液”的有效成分是NaClO。试根据所学知识完成下列问题。
(1)试以食盐、水为原料,设计实验室制取“84消毒液”。(已知电解食盐水可得到氯气、氢氧化钠、水)
①实验内容为:电解食盐水制得氯气;
②实验内容为:?;
反应方程式为:?
③将制得的溶液装瓶保存。
(2)“84消毒液”的消毒原理是(用化学方程式表示)?。用于杀死病菌的成分是?(写化学式)。
参考答案:(7分)(1)②将Cl2通入NaOH(aq)中(2分) ,2NaOH+Cl2===NaCl+NaClO+H2O(2分) (2 )2NaClO+H2O+CO2===Na2CO3+2HClO(2分) ;HClO(1分)
)2NaClO+H2O+CO2===Na2CO3+2HClO(2分) ;HClO(1分)
本题解析:略
本题难度:一般