1、实验题 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
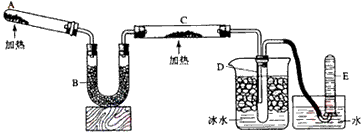
回答下列问题:
(1)A中加入的物质是_________,发生反应的化学方程式是__________________。
(2)B中加入的物质是_________,其作用是__________________。
(3)实验时在C中观察到得现象是_________________,发生反应的化学方程式是_______________。
(4)实验时在D中观察到得现象是__________________,D中收集到的物质是_________,检验该物质的方法和现象是__________________。
参考答案:(1)固体NH4Cl和Ca(OH)2;2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)碱石灰(或CaO);除去NH3气流中的水汽
(3)黑色粉末部分逐渐变为红色;2NH3+3CuO N2+3H2O+3Cu
N2+3H2O+3Cu
(4)出现无色液体;氨水;用红色石蕊试纸检验、试纸变蓝,用无水硫酸铜检验、无水硫酸铜变蓝
本题解析:
本题难度:一般
2、填空题 (12分)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:

步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①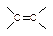 +IBr →
+IBr →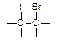
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
⑴已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用?▲?,用方程式表示碘瓶必须干燥的原因?▲?。
⑵步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是?▲?。
⑶步骤Ⅲ中所加指示剂为?▲?,滴定终点的现象?▲?。
⑷反应结束后从液体混合物中回收四氯化碳,则所需操作有?▲?。
参考答案:⑴酸式滴定管(或移液管)? IBr+H2O=HIO+HBr
⑵碘瓶置于暗处可以减少IBr的挥发,不断摇动可以让物质间充分反应。
⑶淀粉溶液?溶液由蓝色恰好变为无色
⑷分液、蒸馏
本题解析:略
本题难度:一般
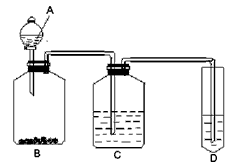
3、实验题 某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):
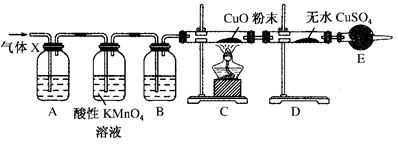
试回答:
(1)上述实验中生成二氧化硫气体的化学反应方程式为
_________________________________________________________。
(2)乙同学认为还可能产生氢气的理由是____________________ _____________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作___________________________________________。
(4)B中加入的试剂是________,其作用是___________________ _____________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中________,D中________。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?
答: ___________________________________________________。
参考答案:(1)Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
(2)在锌与浓硫酸的反应过程中,H2SO4被消耗,且有水生成,c(H2SO4)逐渐减小,由浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气
(3)检验装置气密性
(4)浓硫酸,?吸收水蒸气
(5)黑色氧化铜粉末变成红色, 无水硫酸铜粉末由白色变成蓝色,不能,混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验
本题解析:(1)浓硫酸具有强氧化性,和锌反应的化学方程式是:Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O。
ZnSO4+SO2↑+2H2O。
(2)由于锌在与浓硫酸的反应过程中,H2SO4被消耗,且有水生成,导致c(H2SO4)逐渐减小。当浓硫酸变成稀硫酸后,锌就与稀硫酸反应生成氢气。
(3)任何实验装置连接好以后,都需要检验装置的气密性。
(4)由于要通过无水硫酸铜是否变蓝来证明气体是否含有氢气,所以在和氧化铜反应之前,首先要干燥气体,因此B中加入的试剂是浓硫酸,原来吸收水蒸气。
(5)如果实验中黑色氧化铜粉末变成红色,无水硫酸铜粉末由白色变成蓝色,即可以说明含有氢气;由于混合气体通过KMnO4溶液时会带出水蒸气,干扰后续实验中H2的检验,所以如果撤去装置B,就不能根据D中的现象判断气体X中含有氢气。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的――实验原理;3.结合实验材料,初步确定设计对策--实验方案。
本题难度:一般
4、选择题 下列实验能够达到预期目的的是:
A.在一支盛有2mL 2% CuSO4溶液的试管中,滴入几滴10%的NaOH溶液,再加入1mL乙醛溶液,加热后可以看到红色氧化亚铜沉淀生成
B.将乙酸乙酯与NaOH溶液混合并用水浴加热,即可得到水解产物乙醇和乙酸
C.检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入NaOH溶液中和硫酸,再加入银氨溶液加热
D.在一支试管中滴入10滴溴乙烷,再加入1mL 5%的NaOH溶液,共热后滴加硝酸银溶液,可观察到有浅黄色溴化银沉淀生成
参考答案:C
本题解析:A、新制氢氧化铜中NaOH必须过量;
B、碱性条件下水解,生成的是羧酸盐;
D、水解后必须酸化;否则氢氧根与银离子结合,干扰试验。
本题难度:简单
5、实验题 某学生为验证苯酚、醋酸、碳酸的酸性强弱,经过慎重考虑,设计如下实验装置:请回答下列问题
(1)各仪器中所盛放的药品是A______C______D______,(将序号填入横线上 ①苯酚 ②醋酸 ③碳酸
④Na2CO3 ⑤NaHCO3 ⑥苯酚钠)
(2) 装置C的作用____________。
(3) 试描述能证明三种酸的酸性强弱的现象____________。
(4)写出装置D中发生反应的化学方程式__________________。
参考答案:(1)②;⑤;⑥
(2)除去CO2中的氯化氢
(3)B装置中有气泡,D装置溶液变浑浊
(4)C6H5ONa?+CO2+H2O==C6H5OH+NaHCO3
本题解析:
本题难度:一般