1、选择题 硫酸铵在强热时分解的产物是二氧化硫.氮气.氨气.水,则该反应化合价变化和未变化的氮原子数之比为
A.1:4
B.1:2
C.2:1
D.4:1
参考答案:B
本题解析:3(NH4)2SO4=3SO2↑+N2↑+4NH3↑+6H2O,化合价升高的N原子与化合价不变化的N原子个数比为2:4。
点评:此类问题可先写出方程式再分析。
本题难度:一般
2、选择题 将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为1 mol·L-1
C.第一次剩余9.6 g金属为铜和铁
D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO
参考答案:A
本题解析:第一次加硝酸时金属有剩余,溶液中一定不含Fe3+,所以1 mol金属参加反应均失去2 mol电子,生成2.24 L NO转移0.3 mol电子;消耗金属0.15 mol,质量为18 g-9.6 g="8.4" g,则第一次溶解的金属的摩尔质量为56 g·mol-1,是铁。同理:第二次溶解的金属的摩尔质量为64 g·mol-1,是铜。依据3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,可知c(HNO3)=
3Cu(NO3)2+2NO↑+4H2O,可知c(HNO3)= ×4÷0.2 L="2" mol·L-1;D选项,再加入硝酸,HNO3与0.15 mol Fe2+反应,依据电荷守恒可知生成0.05 mol NO,错误
×4÷0.2 L="2" mol·L-1;D选项,再加入硝酸,HNO3与0.15 mol Fe2+反应,依据电荷守恒可知生成0.05 mol NO,错误
本题难度:一般
3、选择题 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3Sn2++2H3AsO3+6H++18Cl-==2As+3SnCl62-+6M。关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As
③每生成1 mol As,反应中转移电子的物质的量为3 mol
④M为OH- ⑤SnCl62-是氧化产物
A.①②④⑤
B.①③⑤
C.①②③④
D.只有①③
参考答案:B
本题解析:此反应中SnCl2→SnCl62-锡元素价态升高,则SnCl2是还原剂,SnCl62-是氧化产物;故⑤正确;H3AsO3→As中,As元素的化合价降低,故H3AsO3是氧化剂,则生成1 mol As,转移电子的物质的量为3 mol,故①③正确;Cl-不是还原剂,故②错误;由电荷守恒知M为H2O,故④错误。
本题难度:一般
4、选择题 a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(? )
①(a+b)×63 g? ②(a+b)×189 g? ③(a+b)mol? ④(Vc-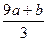 )mol
)mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析: 由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的
由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的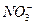 ,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n〔Fe(NO3)3〕="n(Fe)=(a+b)" mol,所以未被还原的硝酸的质量="3" (a+b) mol×63 g·mol-1="(a+b)×189" g,②正确;又根据化合价升降守恒知
,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n〔Fe(NO3)3〕="n(Fe)=(a+b)" mol,所以未被还原的硝酸的质量="3" (a+b) mol×63 g·mol-1="(a+b)×189" g,②正确;又根据化合价升降守恒知
a mol  →a mol
→a mol 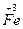 (NO3)3+a mol
(NO3)3+a mol  ?升高(3-2)a+(6+2)a="9a" mol
?升高(3-2)a+(6+2)a="9a" mol
b mol 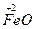 →b mol
→b mol 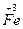 (NO3)3?升高(3-2)b="b" mol
(NO3)3?升高(3-2)b="b" mol
x mol H  →x mol
→x mol 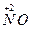 ?降低(5-2)x mol="3x" mol
?降低(5-2)x mol="3x" mol
得9a mol+b mol="3x" mol,即显氧化性的硝酸的物质的量x="(9a+b)/3" mol,所以未被还原的硝酸为(Vc- )mol,④正确网
)mol,④正确网
本题难度:一般
5、选择题 将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是? (? )
A.6g
B.8g
C.10g
D.10.2g
参考答案:D
本题解析:最后沉淀质量=OH-质量+金属质量。由题意可知,金属虽说全溶解,但铁还没有全被氧化成三价铁,加足量的NaOH在空气中不断搅拌,Fe(OH)2将全部被氧化,所以生成的沉淀一定为Mg(OH)2、Fe(OH)3 ,不可能有Fe(OH)2 .在此还要注意的是,整个过程中既有硝酸得电子又有氧气得电子。硝酸得的电子有关系式NO3?~NO~3e-为0.3mol,如再加上空气中氧气得的电子,那么整个过程中得电子数肯定大于0.3 mol,为此金属失去的电子数也大于0.3mol.由于金属阳离子电荷总数等于金属离子结合的OH-数.由 e-~OH-可得金属离子结合的OH-也大于0.3mol.则最后沉淀大于4.9+0.3×17=10g,即生成沉淀大于10g ,选择题中至少必须有一个选项符合要求,本题正确答案只能选D
本题难度:一般