1、实验题 (16分)铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O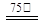 ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O 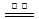 ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O
Ⅱ.ZnSO4·7H2O
Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到
75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入 。
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。
2、填空题 配平下列化学(或离子)方程式:
(1)____Cl2 +____KOH→____KCl+____KClO3 +____H2O
(2)____SO32- +____MnO4- +____H+→____Mn2+ +____SO42- +____H2O
(3)____Cu2S +____HNO3→____Cu(NO3)2 +____NO↑ +____H2SO4 +____H2O
3、计算题 把19.2 g Cu放入足量的稀硝酸中,微热至Cu完全反应。
求:(1)生成的NO在标准状况下的体积。
(2)被还原的硝酸的质量。
4、计算题 (1小题1分,2、3小题各2分,共5分)用15.8 g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?通过计算解答以下问题:
g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
5、填空题 高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式: 。
(2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为 。
(3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为 。