1、实验题 (16分)铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O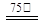 ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O 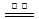 ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O
Ⅱ.ZnSO4·7H2O
Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到
75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入 。
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。
参考答案:(1)a (2分)
(2)①2:1 (2分) ②c (2分)
(3)取最后一次洗涤滤液,滴入1-2滴盐酸酸化的BaCl2溶液,若不出现白色沉淀,表示已洗净。
或者:取最后一次洗涤滤液,加入浓NaOH溶液加热,若不产生使湿润红色石蕊试纸变蓝的气体,表示已洗净。(2分,其它合理答案也给分)
(4)坩埚、泥三角 (漏写给1分,共2分)
(5)①A (2分)
②C (2分)
促进Fe3+水解转化为沉淀并使过量的H2O2分解除去 (答出促进铁离子水解即给2分)
本题解析:(1)根据氧化还原反应的概念,元素的化合价在反应前后发生变化的化学反应是氧化还原反应,反之则是非氧化还原反应,而a中各元素的化合价均未变化,所以不是氧化还原反应;
(2)①根据a反应可知,称量药品时,必须严格控制n(Fe2+)/n (Zn2+)="2:1" ;
②因为ZnC2O4和FeC2O4难溶于水,所以只要将III与I或II混合则会产生ZnC2O4和FeC2O4沉淀,不能生成ZnFe2(C2O4)3·6H2O沉淀,所以不能将III和I混合或I、II、III同时放入,应先将I与II混合,再与III一起加入,则答案选c;
(3)由反应所用的药品可知,该反应除生成ZnFe2(C2O4)3·6H2O沉淀外还生成硫酸铵,ZnFe2(C2O4)3·6H2O沉淀中可能含有硫酸根离子或铵根离子,则证明沉淀洗涤干净可以检验洗涤液中是否含有硫酸根离子或铵根离子。取最后一次洗涤滤液,滴入1-2滴盐酸酸化的BaCl2溶液,若不出现白色沉淀,表示已洗净;或者:取最后一次洗涤滤液,加入浓NaOH溶液加热,若不产生使湿润红色石蕊试纸变蓝的气体,表示已洗净;
(4)加热固体使之分解应在坩埚中进行,所以还需要的硅酸盐仪器是坩埚和泥三角,坩埚放在泥三角上进行加热;
(5)①根据离子沉淀的pH可知,应将亚铁离子氧化为铁离子,便于除去Fe元素杂质,同时不能引入新的杂质,所以选择过氧化氢溶液,将亚铁离子氧化为铁离子,答案选A;
②因为稀硫酸是过量的,应调节溶液的pH在2-4之间,使铁离子完全沉淀,则应加入与稀硫酸反应的物质,同时不能引入新的杂质。若加入Zn,则Zn会与铁离子反应,生成亚铁离子,错误;加入碳酸钙,可以调节溶液的pH,但同时引入钙离子杂质,错误;加入稀硫酸只能使溶液的酸性更强,所以应加入ZnO,只与稀硫酸反应,答案选C;
因为铁离子的水解是吸热反应,加热有利于铁离子的水解,生成氢氧化铁沉淀,从而除去;同时若①步中过氧化氢溶液是过量的,加热可除去过量的过氧化氢。
考点:考查对物质制备原理的分析,离子的检验,方案的分析设计
本题难度:困难
2、填空题 配平下列化学(或离子)方程式:
(1)____Cl2 +____KOH→____KCl+____KClO3 +____H2O
(2)____SO32- +____MnO4- +____H+→____Mn2+ +____SO42- +____H2O
(3)____Cu2S +____HNO3→____Cu(NO3)2 +____NO↑ +____H2SO4 +____H2O
参考答案:(1)3Cl2+6KOH==5KCl+KClO3+3H2O
(2)5SO32-+ 2MnO4-+ 6H+== 2Mn2++ 5SO42-+ 3H2O
(3)3Cu2S+22HNO3==6Cu(NO3)2+10NO↑+3H2SO4+8H2O
本题解析:
本题难度:一般
3、计算题 把19.2 g Cu放入足量的稀硝酸中,微热至Cu完全反应。
求:(1)生成的NO在标准状况下的体积。
(2)被还原的硝酸的质量。
参考答案:(1)4.48L;(2)12.6g。
本题解析:根据公式n=m/M计算,19.2g?的Cu的物质的量为0.3mol,
(1)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol?44.8L
0.3mol? V
V=4.48L,
答:产生的NO在标准状况下的体积为4.48L。
(2)由方程式可以看出,硝酸没有全部被还原,当有3mol铜反应时,有2molHNO3被还原,则0.3mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,质量为:0.2mol×63g/mol=12.6g。
本题难度:一般
4、计算题 (1小题1分,2、3小题各2分,共5分)用15.8 g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?通过计算解答以下问题:
g KMnO4与12mol/L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
参考答案:(5分)(1)66.7 mL(1分)?(2)0.5mol (2分)?(3)5.6L? 0.5mol(2分)
本题解析:略
本题难度:简单
5、填空题 高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式: 。
(2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为 。
(3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为 。
参考答案:(1)2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
(2)1∶5 (3)0.15NA(或9.03×1022)
本题解析:(1)MnO4-→Mn2+为还原过程,故与之对应的应为氧化过程C2O42-→CO2。根据得失电子守恒将方程式配平即可。(2)酸性条件下,KMnO4溶液的氧化性较强,其与浓盐酸反应时,被还原为Mn2+,根据电子守恒可知氧化剂和还原剂(HCl)物质的量之比为1∶5。(3)根据方程式可得关系式:
10FeS ~ 10S ~ Δm ~ e-
880 g 320 g 560 g 30 mol
2.8 g n(e-)
n(e-)=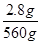 ×30 mol=0.15 mol。
×30 mol=0.15 mol。
本题难度:一般