1、选择题 进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x—时间,y—锥形瓶中碳酸钙减少的质量)( )
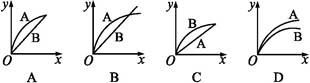
参考答案:C
本题解析:有固体参加的反应速率与固体表面积有关。B锥形瓶中放入粉末状的碳酸钙,所以B中产生的CO2速率比较大;50 mL 1 mol·L-1盐酸最多只能消耗碳酸钙2.5 g,最终产生的CO2应该相等,故C选项的图像符合。
考点:影响化学反应速率的因素
本题难度:一般
2、填空题 (16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的?H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 。
A.升高温度 B.降低压
C.加入更多的SiO2 D.充入N2
某温度下,测得该反应中N2和CO各个时刻的浓度如下,
时间/min
| 0
| 5
| 10
| 15
| 20
| 25
| 30
| 35
| 40
| 45
|
N2浓度/mol·L-1[
| 4.00
| 3.70
| 3.50
| 3.36
| 3.26
| 3.18
| 3.10
| 3.00
| 3.00
| 3.00
|
CO浓度/mol·L-1
| 0.00
| 0.90
| 1.50
| 1.92
| 2.22
| 2.46
| 2.70
| —
| —
| —
|
求0—20 min内N2的平均反应速率V(N2 )= ,该温度下,反应的平衡常数K= 。
参考答案:(1)?H =-1591.2KJ/mol(2)ACD(3)BD
(4)3.70×10-2 mol·L-1·min-1 81.0 mol·L-1
本题解析:
(1)?H =132.6kJ/mol ×12=-1591.2KJ/mol(2)ACD正确,B不正确,速率比等于计量数之比(3)BD 正确,A、升温平衡向吸热的方向移动,逆向移动;C、不正确,SiO2是固体,加SiO2不能改变反应物的浓度。
(4)v(N2)="(" 4.00-3.26) mol·L-1/20mim=3.70×10-2 mol·L-1·min-1
 ,k为81.0 mol·L-1
,k为81.0 mol·L-1
本题难度:一般
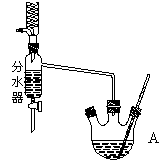
3、实验题 下图为制取乙酸乙酯的实验装置图。回答下列问题:
揭示实验原理
乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。
参考答案:①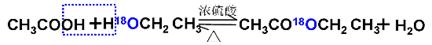 ②否。醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基。反应速率低,达不到催化剂活性温度;温度过高利于平衡逆向移动,酯产率降低。用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率。酚酞。碳酸钠层呈红色,上层的酯层呈无色。
②否。醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基。反应速率低,达不到催化剂活性温度;温度过高利于平衡逆向移动,酯产率降低。用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率。酚酞。碳酸钠层呈红色,上层的酯层呈无色。
本题解析:揭示反应原理:①酯化反应中羧酸提供羟基,醇提供氢原子,用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式为
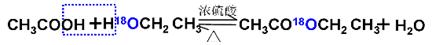 。②由于醇和羧酸都提供氢原子,因此不能用氢同位素示踪法揭示酯化反应原理。确定反应温度:温度过低,反应速率慢,且达不到催化剂活性温度,所以温度不能低于85℃;该反应正反应是放热反应,温度过高平衡逆向移动,酯产率降低,所以也不能高于85℃。实验装置的比较:根据装置图的结构特点可判断,用分水器能够在反应进行时很容易的把水分离出来,从而降低生成物浓度,使平衡正向移动,提高乙酸乙酯的产率。酯层厚度的标示:由于碳酸钠溶液显碱性,能使酚酞试液显红色,所以应该滴入酚酞试液,实验现象是碳酸钠层呈红色,上层的酯层呈无色。
。②由于醇和羧酸都提供氢原子,因此不能用氢同位素示踪法揭示酯化反应原理。确定反应温度:温度过低,反应速率慢,且达不到催化剂活性温度,所以温度不能低于85℃;该反应正反应是放热反应,温度过高平衡逆向移动,酯产率降低,所以也不能高于85℃。实验装置的比较:根据装置图的结构特点可判断,用分水器能够在反应进行时很容易的把水分离出来,从而降低生成物浓度,使平衡正向移动,提高乙酸乙酯的产率。酯层厚度的标示:由于碳酸钠溶液显碱性,能使酚酞试液显红色,所以应该滴入酚酞试液,实验现象是碳酸钠层呈红色,上层的酯层呈无色。
本题难度:一般
4、选择题 下述实验不能达到预期实验目的是( )
| 序号 | 实验内容 | 实验目的
A
将2.5g?CuSO4?5H2O溶解在97.5g?水中
配制质量分数为1.6%的CuSO4溶液
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
室温下,用pH试纸测定浓度为0.1mol?L-1 NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
|
A.A
B.B
C.C
D.D
参考答案:A.2.5gCuSO4?5H2O中CuSO4的质量为2.5g×160250=1.6g,溶液的质量为2.5g+97.5g=100g,则配制质量分数为1.6%的CuSO4溶液,故A正确;
B.因硫化银比氯化银更难溶,则向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液,会得到黑色沉淀,说明一种沉淀能转化为另一种更难溶的沉淀,故B正确;
C.pH试纸不能测出NaClO溶液的pH,能使试纸褪色,则不能用pH试纸测定浓度为0.1mol?L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH来比较HClO和CH3COOH的酸性强弱,故C错误;
D.固定其他因素不变,则稀硫酸的浓度不同,反应的反应速率不同,故D正确;
故选C.
本题解析:
本题难度:简单
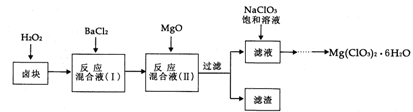
5、简答题 (14分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
 ?
?
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
回答下列问题:
(1)加速卤块在H2O2溶液中溶解的措施有:??(写出一条即可)。
(2)加入MgO的作用是?;滤渣的主要成分为?。
(3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为??,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为①蒸发结晶;②?;③____;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为: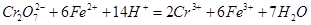 。
。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-):?;
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)?。
参考答案:(1)将卤块粉碎或加热等;(2)调节溶液的pH,使Fe3+沉淀完全,BaSO4和Fe(OH)3
(3)MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,②趁热过滤,③冷却结晶;
(4)①ClO3-+5Fe2++6H+=6Fe3++Cl-+3H2O,②78.3%.
本题解析:(1)影响化学反应速率的因素有三个温度、将固体粉碎成细小的颗粒、增加物质的浓度等。因此加速卤块在H2O2溶液中溶解的措施有将卤块粉碎或加热等;(2)金属氧化物MgO能与酸反应产生盐和水。所以加入MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去。根据示意图可知滤渣的主要成分为BaSO4和Fe(OH)3。(3)向滤液中加入NaClO3饱和溶液后,发生反应MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,然后利用NaCl、Mg(ClO3)2的溶解度与温度的关系将溶液蒸发浓缩结晶、②趁热过滤,③冷却结晶,最后④过滤、洗涤。就得到Mg(ClO3)2·6H2O。(4)①步骤2中发生反应的离子方程式ClO3-+5Fe2++6H+=6Fe3++Cl-+3H2O,②在氧化反应反应中电子转移数目相等。n(Fe2+)×1=n(ClO3-)×6+n(Cr2O72-)×2×3. n(Fe2+)="0.02mol;" n(Cr2O72-)=0.0015mol;所以n(ClO3-)={0.02mol×1-0.0015mol×2×3}÷6=0.0018mol;因此100ml中含有的ClO3-的物质的量为0.0183mol,则含有的Mg(ClO3)2·6H2O的物质的量为0.00915mol.去质量为299g/mol×0.00915mol=2.7408g.因此产品中Mg(ClO3)2·6H2O的质量分数为(2.7408g÷3.50 g)×100%=78.3%.
本题难度:一般