1、选择题 100.0mL 6.0mol·L-1H2SO4(aq)跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入的物质是
A.Na2CO3(s)
B.水
C.Cu
D.(NH4)2SO4(s)
2、选择题 在2A+B 3C+4D反应中,表示该反应速率最快的是(?)
3C+4D反应中,表示该反应速率最快的是(?)
A.
B.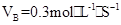
C.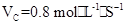
D.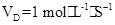
3、实验题 (12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
①分别取等体积的2 mol/L
硫酸于试管中;
②分别投入大小、 形状相同 形状相同
的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
|
该同学的实验目的是研究  对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 条件相同。
条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
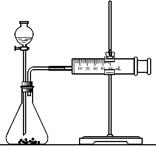
完成该实验应选用的实验药品是
;应该测定的实验数据是 。
4、选择题 下列实验设计不能达到预期目的是( )
| 选项 | 实验操作 | 实验目的
?A
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种更难溶的沉淀
?B
在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液
研究催化剂对反应速率的影响
?C
向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,边滴边用玻璃棒搅拌,继续煮沸
制备Fe(OH)3胶体
?D
将铜片和锌片用导线连接后同时插入稀硫酸溶液中
比较锌和铜的金属活泼性
|
A.A
B.B
C.C
D.D
5、计算题 一定温度下,在密闭容器中,发生反应:2NO2 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,求:
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,求:
(1)NO2的起始浓度。
(2)此时NO2的分解率。