1、选择题 100.0mL 6.0mol·L-1H2SO4(aq)跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入的物质是
A.Na2CO3(s)
B.水
C.Cu
D.(NH4)2SO4(s)
参考答案:B
本题解析:A错,加入Na2CO3(s)能与硫酸反应,使溶液中硫酸的物质的量减小,氢气量减少;B正确,加水,溶液中氢离子浓度降低,反应速率减慢,同时溶液中氢离子的物质的量不变,生成氢气的物质的量不变;C错,加铜会形成锌铜稀硫酸原电池,加快反应速率,生成氢气的总量不变;D错,加入(NH4)2SO4(s),溶液的氢子浓度基本上变化不大(浓度增大不是很大),反应速率基本不变,生成氢气总量基本不变。
本题难度:一般
2、选择题 在2A+B 3C+4D反应中,表示该反应速率最快的是(?)
3C+4D反应中,表示该反应速率最快的是(?)
A.
B.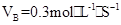
C.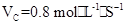
D.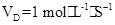
参考答案:B
本题解析:用各元素表示的反应速率之比等于化学计量数之比,A: ,B:VA=2VB=0.6
,B:VA=2VB=0.6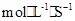 ;C:VA=
;C:VA=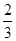 VC=0.53
VC=0.53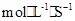 ;D:VA=
;D:VA=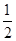 VD=0.5
VD=0.5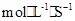 ,故表示反应速率最快的是B。
,故表示反应速率最快的是B。
点评:要比较反应速率的快慢,先把反应速率转换成用同一种物质表示,再进行比较
本题难度:简单
3、实验题 (12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
①分别取等体积的2 mol/L
硫酸于试管中;
②分别投入大小、 形状相同 形状相同
的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
|
该同学的实验目的是研究  对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 条件相同。
条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
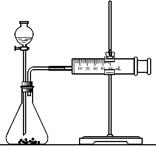
完成该实验应选用的实验药品是
;应该测定的实验数据是 。
参考答案:(共12分)
(1)反应物本身的性质;温度;(每空2分)
(2)Mg(或Fe)、0.5mol/L硫酸和2mol/L硫酸;(6分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
本题解析:略
本题难度:困难
4、选择题 下列实验设计不能达到预期目的是( )
| 选项 | 实验操作 | 实验目的
?A
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种更难溶的沉淀
?B
在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液
研究催化剂对反应速率的影响
?C
向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,边滴边用玻璃棒搅拌,继续煮沸
制备Fe(OH)3胶体
?D
将铜片和锌片用导线连接后同时插入稀硫酸溶液中
比较锌和铜的金属活泼性
|
A.A
B.B
C.C
D.D
参考答案:A.由沉淀转化中溶解度小的向溶解度更小的方向移动,则向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液,可观察到白色沉淀转化为黑色沉淀,说明一种沉淀能转化为另一种更难溶的沉淀,故A正确;
B.氯化铁在过氧化氢分解中作催化剂,则在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液,观察到加氯化铁的反应快,可说明催化剂对反应速率的影响,故B正确;
C.向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,可制备胶体,但制备胶体的过程中,不能搅拌或加热,搅拌或加热能发生胶体聚沉,故C错误;
D.原电池中负极金属较活泼,则将铜片和锌片用导线连接后同时插入稀硫酸溶液中,Zn作负极,可比较锌和铜的金属活泼性,故D正确;
故选C.
本题解析:
本题难度:简单
5、计算题 一定温度下,在密闭容器中,发生反应:2NO2 2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,求:
2NO+O2,经过一定时间后,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1,且各物质的浓度不再发生变化,求:
(1)NO2的起始浓度。
(2)此时NO2的分解率。
参考答案:(1)0.3 mol·L? (2)80%
本题解析:(1)因c(O2)="0.12" mol·L,所以消耗c(NO2)=2×0.12 mol·L="0.24" mol·L,则NO2的起始浓度为0.24 mol·L+0.06 mol·L="0.3" mol·L
(2)NO2的分解率=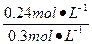 ×100%=80%
×100%=80%
本题难度:简单