1、实验题 (16分)
黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫(假设矿石中的杂质不参与化学反应)。某化学学习小组对黄铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
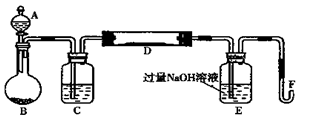
I.实验装置如下图所示(夹持和加热装置省略)。A中的试剂是双氧水,将m1g该黄铁矿样品放入硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管中的黄铁矿样品至反应完全。
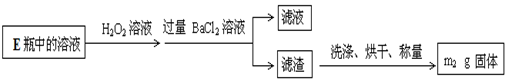
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
① 用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
② 加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③ 将滤液稀释至250 ml;
④ 每次取稀释液25.00 ml,用已知物质的量浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V ml。
请回答下列问题:
(1)仪器B中发生反应的化学方程式是;仪器C中装入的试剂是。E瓶的作用是。
(2)II中加入H2O2发生反应的离子方程式。
(3)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还必须要有;④中取稀释液25.00 ml需用的仪器是。
(4)假设在整个实验过程中硫元素和铁元素没有损失,则该黄铁矿样品中硫元素的质量分数为。(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为。(用含m1、c、V的代数式表示)
参考答案:

本题解析:(1)黄铁矿在高温时和氧气反应,所以A的作用是提供反应所需要的氧气,用过氧化氢制取氧气的方程式为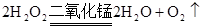 ;仪器C之后,气体进入了加热装置所以C装置的作用是干燥气体,所以C中放的是浓硫酸;由于反应中由二氧化硫产生所以E瓶的作用是吸收反应生成的二氧化硫,使其全部转化为亚硫酸根离子,有利于根据亚硫酸根离子的量计算样品中硫元素的质量。
;仪器C之后,气体进入了加热装置所以C装置的作用是干燥气体,所以C中放的是浓硫酸;由于反应中由二氧化硫产生所以E瓶的作用是吸收反应生成的二氧化硫,使其全部转化为亚硫酸根离子,有利于根据亚硫酸根离子的量计算样品中硫元素的质量。
(2)向亚硫酸钠溶液中加入H2O2发生反应的离子方程式为: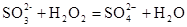
(3)步骤③是一个稀释溶液的题,并且要求稀释到一定的体积,所以需要的仪器除玻璃棒烧杯外还需要胶头滴管,250ML容量瓶。酸性KMnO4溶液具有强氧化性所以在吸取25.00 ml酸性KMnO4溶液时必须要用酸式滴定。
(4)硫元素质量分数:m2固体为硫酸钡固体,可以计算出其物质的量为 ,根据硫守恒可以算出硫元素质量为:
,根据硫守恒可以算出硫元素质量为: 所以样品中硫元素的质量分数为
所以样品中硫元素的质量分数为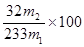 % ,铁元素的质量分数:酸性高锰酸钾与亚铁离子反应的方程式为
% ,铁元素的质量分数:酸性高锰酸钾与亚铁离子反应的方程式为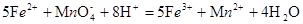 ?滴定消耗的高锰酸钾
?滴定消耗的高锰酸钾 ?,根据方程式可以计算出25ML稀释液中亚铁离子的物质的量为
?,根据方程式可以计算出25ML稀释液中亚铁离子的物质的量为 ,所以250 ML溶液中共有亚铁离子的物质的量为
,所以250 ML溶液中共有亚铁离子的物质的量为 ?,据此可得出原样品中铁元素的质量为
?,据此可得出原样品中铁元素的质量为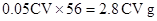 ?样品中铁元素的质量分数为
?样品中铁元素的质量分数为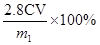
本题难度:一般
2、实验题 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。该实验的主要操作步骤如下
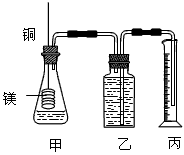
a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用____________量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为__________g;
d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录___________;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应_________________________,读出量筒中水的体积为V mL。
回答下列问题:
(1)请将上述步骤补充完整
(2)用文字表述d检查该装置气密性的操作与观察方法:___________________。
(3)本实验中应选用_____________ (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____________。
(5) 简述速率不等的原因___________________,铜丝不与酸接触的原因是______________________。
参考答案:(1)酸式滴定管或10ml的量筒;0.12;反应时间;将量筒缓缓向下移动,使乙、丙中液面相平(或调节乙、丙仪器中的液面使之相平)?
(2)两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(答案合理均可)
(3) B
(4)0.2VL/mol
(5)盐酸与醋酸的浓度相同时c(H+)不同 ;防止形成原电池,干扰实验现象的观察及实验结果的准确性
本题解析:
本题难度:困难
3、实验题 (15分)从固体混合物A出发可以发生如下框图所示的一系列变化。

(1)在实验室,气体C的检验方法是??。 ? (2)操作②的名称是 ?,该操作所使用的玻璃仪器有?。
(3)写出下列反应的离子方程式:
反应③ ??;
反应④ ??。
(4)实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是??(填序号)。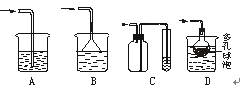
参考答案:

本题解析:略
本题难度:简单
4、选择题 下列有关事实或现象的解释正确的是
A.SO2气体能使品红和酸性高锰酸钾溶液褪色,且原理相同
B.氨气可将NO2 转化成无毒的物质,是因为氨气具有还原性
C.NH4NO3溶液和HNO3溶液中滴加石蕊都变红色,是因为它们均能电离出H+
D.pH=3的盐酸与pH=11的MOH溶液等体积混合后溶液呈碱性,说明MOH为弱碱
参考答案:BD
本题解析:A:褪色原理不同,SO2分别表现为漂白性和还原性,排除
B:由NH3+NO2 N2+H2O可知,氨气做还原剂,正确
N2+H2O可知,氨气做还原剂,正确
C:前者是由于盐的水解,后者是由于酸的电离,排除
D:若MOH为强碱,则恰好中和,溶液为中性,而最终为碱性,说明碱溶液中存在电离平衡,可补充OH—,为弱碱,正确
故答案为BD
本题难度:简单
5、实验题 将无水乙醇逐滴滴入到红热的CuO中,生成的气体通过某白色粉末(装置外边用冰水冷凝)。 实验结果表明:
(I)白色粉末变蓝,并在上边凝有沸点为21℃的无色液体X。
(Ⅱ)X不能与溴水发生加成反应。
(Ⅲ)X能进行卤代反应,一分子X中最多只能有三个H原子被取代,实验测得4. 6g无水乙醇全部反应后, CuO失重1.6g。
(1)根据上述实验数据,可算出每个乙醇脱去的H原子数,从而得出液体X的化学式为__________ 。
(2)根据有机物分子结构理论,把乙醇分子在上述反应中的三种可能脱氢方式(在乙醇的结构式中用 表示脱去的氢原子)和脱氢生成物的结构式填入下表空格中。
表示脱去的氢原子)和脱氢生成物的结构式填入下表空格中。

(3)在上述三个产物中只有--式是液体X的结构式,请简述另外两式均不合理的原因。 ________________。
参考答案:(1)CH3CHO
(2)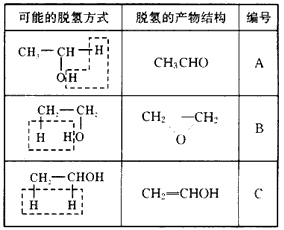
(3)A 因为B式有4个等同的氢,而C式中有C=C与X具有的性质Ⅱ不符
本题解析:
本题难度:一般