1、填空题 (8分)用下图所示的实验过程,测定含Na2SO4的亚硫酸钠中Na2SO3 的质量分数。
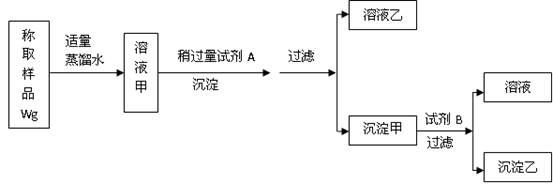
测定沉淀(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是?,沉淀乙是?;
(2)试剂B溶液选用稀盐酸,不能选用稀硝酸的原因是?;
(3)沉淀甲与试剂B反应的离子方程是?;
(4)计算含Na2SO4的亚硫酸钠中Na2SO3 的质量数??。
参考答案:(1)BaCl2或Ba(OH)2溶液; BaSO4
(2)硝酸能把BaSO3氧化成 BaSO4
(3)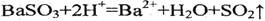
(4)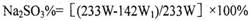
本题解析:本题重点考察学生对硫酸盐和亚硫酸盐性质的掌握程度。取固体加入蒸馏水之后,获得了Na2SO4和Na2SO3的水溶液,当向其中加入过量A时产生了沉淀,由于高中化学中BaSO4是一种常见的沉淀,学生很容易会想的加入了Ba2+ 所以试剂A中含有Ba2+ ,可以为BaCl2或Ba(OH)2溶液,同时由此可判断沉淀甲为BaSO4和BaSO3的混合物,溶液乙为NaCl,由于加入试剂 B后产生了溶液和沉淀乙,说明沉淀可能部分发生了溶解,结合沉淀物的性质可判断溶剂B为酸,亚硫酸钡溶于酸,而硫酸钡不溶于酸。
(1)试剂A是BaCl2或Ba(OH)2溶液;沉淀乙不溶于试剂B所以沉淀是BaSO4
(2))硝酸具有强氧化性会将亚硫酸钡氧化为硫酸钡,这样无法分离出混合沉淀中原有的硫酸钡,最后无法计算样品中亚硫酸钠的质量分数。
(3)沉淀甲为BaSO4和BaSO3的混合物,当向其中加入酸时会与BaSO3会与酸反应离子反应方程式为
(4)根据反应后剩下沉淀乙硫酸钡的质量计算出其物质的量W1,反应过程中硫酸根离子物质的量守恒可以得出混合物样品中硫酸钠的物质的量,进而求出硫酸钠的质量,用总质量减去硫酸钠的质量即可求出亚硫酸钠的质量,即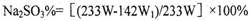
本题难度:一般
2、实验题 (16分)
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。
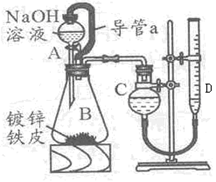
回答下列问题 :
(1)仪器名称A??_B??
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D?(具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后?,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为?。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液?。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:

参考答案:(1)分液漏斗,锥形瓶
(2)将AB连通,平衡两者气压,使液体能顺利流下
(3)C中液面与D中液面相平;C中液面与D中液面相平;保证BC装置内的气压始终恒定。
(4)2Al + 2OH— + 2H2O = 2AlO2— + 3H2↑
(5)参考方案:取B 反应后剩余液,加入足量稀硝酸酸化,再滴入KSCN溶液,未见变红(其他方案合理亦可)
(6) h=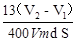
(7) 参考1:镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算
参考2:镀锌铁皮与盐酸反应后,根据金属的质量及产生氢气的体积进行换算
参考3:镀锌铁皮与盐酸反应后,在余下液体中加入足量强碱,过滤洗涤灼烧根据产生的氧化铁质量换算
(其他方案:在中学生所知范围内,合理即可)
本题解析:(1)在做制备氯气的实验中用过这些一起,A为分液漏斗。B为锥形瓶。(2)为了使反应顺利进行,反应漏斗的试剂顺利滴下,需要保持压强的内外一致,因此需要导管a这个装置,装置中导管 a 的作用是:将AB连通,平衡两者气压,使液体能顺利流下。(3)本实验的关键是测量气体的体积。根据此装置的原理,应两次记录C中的读数,取其差值就是所得气体的体积,因此干燥管C与量气管D(具有刻度的细长玻璃管)在反应前后液面高度都是相平的。(4)根据所学知识,铝可与强碱溶液反应,离子方程式为:2Al + 2OH— + 2H2O = 2AlO2— + 3H2↑。(5)利用铁离子(Fe3+)的特征反应,遇KSCN溶液变红来检验铁是否参与了反应,方案为:取B 反应后剩余液,加入足量稀硝酸酸化,再滴入KSCN溶液,未见变红(其他方案合理亦可)。(6)根据体积只差算出放出H2的体积,利用化学方程式:Zn+20H-=Zn022-+H2↑,计算出Zn的质量,再用m=ρV=ρSh,得出h=m/(ρS),带入数据,解得h=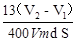 。(7)这题是开放题,只要符合题意的方案都是可以的。
。(7)这题是开放题,只要符合题意的方案都是可以的。
点评:本题考查的是化学实验的基本操作及相关计算,测重基本实验操作能力考查。化学计算注重解题技巧,尤其是最后一题考查思维的深刻性和灵活性。
本题难度:一般
3、实验题 硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁 药片外表面包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治疗贫血的药效)。试设计一个方法,验证某硫酸亚铁药片是否已被氧化(写出主要步骤、现象及有关反应式)。
参考答案:刮去糖衣,把药片研碎,放在烧杯中加少量蒸馏水溶解,滴几滴KSCN溶液,溶液显红色,可知部分或全部亚铁离子已被氧化。 Fe3++SCN-=[Fe(SCN)]2+
本题解析:
本题难度:一般
4、选择题 下列实验操作正确且能达到预期目的的是
选项
| 实验目的
| 操作
|
A
| 比较水和乙醇中羟基氢的活泼性强弱
| 用金属钠分别与水和乙醇反应
|
B
| 证明CH2=CHCHO中含有碳碳双键
| 滴入KMnO4酸性溶液
|
C
| 比较盐酸与醋酸的酸性强弱
| 分别测定同温同浓度NaCl与CH3COONa溶液的pH
|
D
| 除去苯中混有的苯酚
| 向混合液中加入过量浓溴水,充分反应后,过滤
|
?
参考答案:AC
本题解析:A、高锰酸钾溶液与正确;B、CH2=CHCHO含有碳碳双键和醛基,均能与高锰酸钾溶液反应,错误;C、酸越弱,其对应盐水解程度越大,正确;D、反应生成的三溴苯酚溶解于苯,同样不能除去,错误。
本题难度:一般
5、实验题
为了探究草酸(H2C2O4)的化学性质,设计如下3个实验:
实验1:取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
(1)该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是__________________。
实验2:取少量草酸晶体装入试管,加水溶解,向试管里滴加足量的澄清石灰水,有白色沉淀生成。
(2)该实验说明草酸具有______性。写出反应的化学方程式:__________________。
实验3:草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为了探究草酸的不稳定性,某同学设计如下实验装置
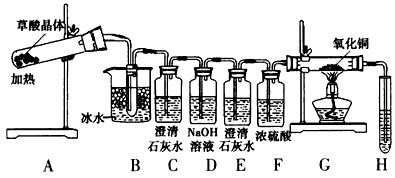
(3)B装置的作用是__________________。C装置变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式:__________________。
(4)为了检验G中反应的氧化产物,H试管所装试剂是___________,从环境保护角度来看,该方案的不足之处是________________________。
参考答案:
(1)还原;锰离子起催化作用或锰离子浓度增加,加快了反应速率
(2)酸;Ca(OH)2+H2C2O4=CaC2O4↓+2H2O
(3)冷凝草酸蒸气,避免对二氧化碳的检验产生干扰;H2C2O4 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
(4)澄清石灰水(或偏铝酸钠溶液或硅酸钠溶液等);没有尾气处理装置
本题解析:
本题难度:一般