1、选择题 将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中还含有能金属或金属离子是( )
A.Cu、Fe3+
B.Cu、Fe2+
C.Cu、Fe2+
D.Fe2+、Fe3+
参考答案:将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,因氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,
如Fe有剩余,则剩余的金属一定有Cu,
溶液中不存在Fe3+、Cu2+,含有Fe2+,
故选B.
本题解析:
本题难度:简单
2、填空题 现有下列物质?①新制氯水?②铁?③铜?④稀硫酸
(1)将Fe2+转化为Fe3+,可选用的物质______
(2)将Fe3+转化为Fe2+,可选用的物质______.
参考答案:(1)将Fe2+转化为Fe3+,铁元素化合价升高被氧化,需要加入的物质具有氧化性;①新制氯水中的氯气是强氧化剂,故新制氯水可以;
而②铁、③铜、④稀硫酸,都没有强氧化性,不能氧化Fe2+;
故答案为:①;
(2)Fe3+转化为Fe2+,铁元素化合价降低被还原,需要加入的物质具有还原性,②铁和③铜具有较强的还原性,能够还原Fe3+,故答案为:②③.
本题解析:
本题难度:简单
3、选择题 用16g某饱和一元醇跟足量金属钠完全反应,产生5.6L氢气(标准状况),该醇是
A.甲醇
B.乙醇
C.丙醇
D.丁醇
参考答案:A
本题解析:5.6L氢气(标准状况)是0.25mol,由于2个羟基才能产生1分子氢气,所以该饱和一元醇的物质的量是0.5mol,则其相对分子质量是16÷0.5=30。根据饱和一元醇的通式CnH2n+2O可知,醇是甲醇,答案选A。
本题难度:一般
4、填空题 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是?;Y与过量浓硝酸反应后溶液中含有的盐的化学式为?。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是?。
A.Mg2+?B.Fe2+?C.Al3+?D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
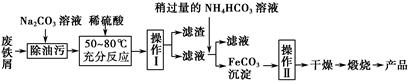
回答下列问题:
①操作Ⅰ的名称是?;操作Ⅱ的名称是?;操作Ⅱ的方法为?。
②请写出生成FeCO3沉淀的离子方程式: ?。
参考答案:(1)Fe2+、Fe3+、H+ Fe(NO3)3
(2)BC
(3)①过滤 洗涤 在漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复2~3次
②Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
本题解析:(1)铁的氧化物中具有磁性的是Fe3O4,Fe3O4溶于过量的盐酸后溶液中存在的阳离子是Fe2+、Fe3+、H+;Fe3O4溶于过量的浓硝酸后Fe元素会被氧化为Fe3+,所以反应后的溶液中含有的盐是Fe(NO3)3。(2)向该溶液中加入过量的NaOH溶液后:Mg2+→Mg(OH)2、Fe2+→Fe(OH)3、Al3+→[AlCO4]-、Cu2+→Cu(OH)2;过滤后滤渣中含有Mg(OH)2、Fe(OH)3、Cu(OH)2;高温灼烧后Mg(OH)2→MgO、Fe(OH)3→Fe2O3、Cu(OH)2→CuO;将MgO、Fe2O3、CuO投入过量盐酸后生成Mg2+、Fe3+、Cu2+,故应选择B、C。(3)①从流程图中知道经操作Ⅰ得到滤渣,故该操作是过滤;操作Ⅱ是在得到FeCO3沉淀后进行的,故该操作是洗涤;洗涤具体操作方法为:在漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复2~3次;②从流程图中分析加入稍过量的NH4HCO3溶液,有FeCO3沉淀,还应有CO2生成,发生复分解反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。
本题难度:一般
5、填空题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验“.
请回答该实验中的问题.
(1)写出该反应的化学方程式______.
(2)实验前必须对整套装置进行的操作是______.
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是______.
(4)试管中要收集干燥的气体,干燥管中盛装的物质是______,作用是______.
(5)试管中收集到的气体是______,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行______,这一操作的目的是______.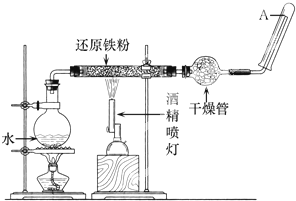
参考答案:(1)铁与水蒸气发生氧化还原反应:3Fe+4H2O ?△?.?Fe3O4+4H2,故答案为:3Fe+4H2O ?△?.?Fe3O4+4H2;
(2)实验前必须对整套装置进行气密性检查,故答案为:检验装置的气密性;
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,故答案为:为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;
(4)干燥氢气可以用碱石灰干燥剂,故答案为:碱石灰;除去反应产生的H2中的水蒸气;
(5)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸.故答案为:氢气;验纯;防止点燃时,氢气因含有氧气而爆炸.
本题解析:
本题难度:一般