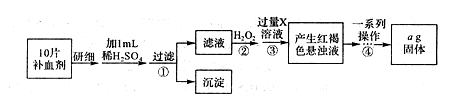
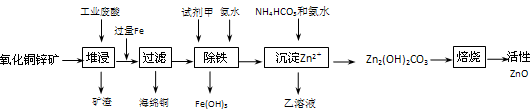
1、填空题 (14分))某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 6.34
| 9.7
|
Fe3+
| 1.48
| 3.2
|
Zn2+
| 6.2
| 8.0
|
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS)??Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的?(填序号)作为试剂甲是比较合适的。
A.KMnO4? B.O2? C.H2O2? D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在?范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式?。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __??mol/L以下。
[Fe(OH)3的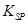 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是?。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式?。
2、填空题 化学兴趣小组为探究某铁矿石(主要成分为Fe203和Si02)的性质,进行如下实验:
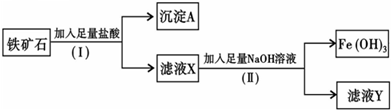
(1)步骤(I)中分离溶液和沉淀的操作名称是______;
(2)沉淀A中一定含有______,该物质属于______(填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈______(填“黄色”或“红色”);
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式______.
3、选择题 在Fe , Cu的混合物中加入一定量的稀硝酸并微热,充分反应后剩余金属a克。再向其中加入一定量的稀盐酸并加热,充分振荡后还剩余金属b克。则[
A.a一定大于b
B.a一定等于b
C.a可能小于b
D.a可能等于b
4、选择题 在下列溶液中分别放入铁棒,过一会儿再把铁棒取出,能使铁棒质量增加的溶液是( )
A.氯化镁溶液
B.氢氧化钠溶液
C.盐酸
D.硫酸铜溶液
5、实验题 (14分)FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用____(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;
②____________________。
(4) FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制