1、简答题 化学对人类社会进步和发展的贡献之一是研制和发现了各种材料,例如金属就是我们生活中不可或缺的重要材料.请根据你学过的有关金属的知识,回答下列问题:
(1)铜钱在我国历史上曾经是一种广泛流通的货币.铜常用于制造货币的原因可能是______.
A.铜的熔点不是太高,易于冶炼、铸造成型B.铜的性质不活泼,不易被腐蚀
C.我国较早的掌握了湿法冶炼铜的技术D.自然界有大量的游离态的铜
(2)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为______.
参考答案:(1)A.铜的熔点不是太高,易于冶炼、铸造成型,可应用于制造货币,故A正确;
B.铜的性质不活泼,不与空气中的水氧气等反应,不易被腐蚀,故B正确;
C.我国较早的掌握了湿法冶炼铜的技术,利用Fe与硫酸铜反应生成Cu,故C正确;
D.自然界有大量铜矿,开采后提炼Cu,故D错误;
故答案为:ABC;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该反应为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O.
本题解析:
本题难度:一般
2、选择题 镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
[? ]
A.Mg2+
B.Cu2+
C.Al3+
D.AlO2-
参考答案:D
本题解析:
本题难度:一般
3、实验题 学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料: 该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:?取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
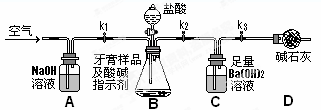
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体;?
B.滴加盐酸不宜过快;
C.在A—B之间增添盛有浓硫酸的洗气装置?
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______________。
参考答案:(1) Al(OH)3+OH-=AlO2-+2H2O;(2)通入CO2气体有白色沉淀生成,加入盐酸后有气体生成,沉淀溶解;(3)把生成的CO2气体全部排入C中,使之全部被Ba(OH)2溶液吸收;(4)CO2+Ba(OH)2=BaCO3↓+H2O;(5)C,D;(6)25%;(7)B中的水蒸气、氯化氢等装置排入C中。
本题解析:(1) 氢氧化铝与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;(2)(1)所得滤液中含NaOH、NaAlO2,往(1)所得滤液中,通入过量二氧化碳,首先发生反应:2NaOH+CO2=Na2CO3+H2O,然后发生:CO2++2H2O +NaAlO2= Al(OH)3+ NaHCO3; Na2CO3+H2O+CO2="2" NaHCO3;再加入过量稀盐酸,会发生反应:Al(OH)3+3HCl=AlCl3+3H2O ;NaHCO3+HCl=NaCl+H2O+ CO2↑。所以会观察到的现象:通入CO2气体有白色沉淀生成,加入盐酸后有气体生成,沉淀溶解;(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有就是把生成的CO2气体全部排入C中,使之全部被Ba(OH)2溶液吸收;(4)C中反应生成BaCO3的化学方程式是CO2+Ba(OH)2=BaCO3↓+H2O;(5)A.在加入盐酸之前,应排净装置内的CO2气体;可以减少装置的空气中的CO2气体产生的影响,减小实验误差,错误;B.滴加盐酸不过快就可以式产生的气体被充分的吸收,提高所以的准确性;错误;C.在A—B之间增添盛有浓硫酸的洗气装置,只能吸收水分,而在后边的装置中的气体吸收就是在溶液中进行的,所以不会影响测定准确度,正确;D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置,可以使装置B挥发出的HCl被吸收而产生CO2气体,使CO2气体增多,因此使测定准确度降低,正确。(6)根据C元素守恒可得关系式:CaCO3~CO2~BaCO3。n(BaCO3)=3.94g÷197g/mol=0.02mol,则n(CaCO3)=0.02mol,所以m(CaCO3)=0.02mol×100g/mol=2g。则样品中碳酸钙的质量分数为(2÷8)×100%25%;(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是B中的水蒸气、氯化氢等装置排入C中,所以质量分数会偏大。
本题难度:一般
4、简答题 将0.1mol镁、铝合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀与所加NaOH溶液体积的关系如图所示.试回答下列问题:
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,V(NaOH)=______mL;
(2)当V1=160mL时,金属粉末中镁的物质的量为多少?此时V2的值又是多少?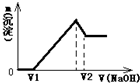
参考答案:将镁、铝合金溶于H2SO4溶液中,发生反应:Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑.0.1mol镁、铝合金,完全反应需要硫酸范围:0.1mol<n(H2SO4)<0.15mol,H2SO4有剩余(观察图象更容易得出),溶液是MgSO4、
Al2(SO4)3和H2SO4混合液.
①0--V1阶段,滴加的NaOH用于中和剩余的H2SO4,发生反应是:H2SO4+2NaOH=Na2SO4+2H2O
②V1ml时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液.
③V1--沉淀量最大阶段,继续滴加的NaOH与MgSO4、Al2(SO4)3反应,产生沉淀,发生反应:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
④沉淀量最大时时,MgSO4、Al2(SO4)3完全反应,沉淀达到最大值,此时,溶液是Na2SO4溶液.
⑤沉淀量最大--V2ml阶段,继续滴加的NaOH与Al(OH)3反应,沉淀量开始减少,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O
⑥V2ml时,Al(OH)3完全反应,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.
(1)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,此时,V(NaOH)=0.4mol1mol/L=0.4L=400ml
故答案为:400;
(2)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=12n(Na+)=12n(NaOH)=12×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,根据Mg原子、Al原子、SO42-离子守恒有:
本题解析:
本题难度:一般
5、选择题 向含有MgCl2、AlCl3两种溶质的混合溶液中逐滴滴加7mLNaOH溶液后再逐滴滴加盐酸至不再发生化学反应,所得沉淀的物质的量Y与所加试剂的体积V之间的关系如图所示,以下结论错误的是(不考虑Mg2+、Al3+的水解)?
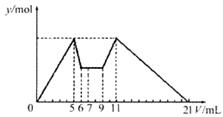



A.上述NaOH溶液和HCl溶液的物质的量浓度之比为2:1
B.原混合溶液中c(Al3+):c(Mg2+):c(Cl一)=1:1:5
C.当加入的HCl溶液的体积为4mL时,溶液中c(Na+):c(C1一)=1:2
D.最终得到的溶液中c(A13+):c(Mg2+):c(Cl )=1:1:14
)=1:1:14
参考答案:CD
本题解析:当加入的HCl溶液的体积为11-7=4mL时,因沉淀达到最大量,溶液中溶质只有NaCl,故溶液中c(Na+):c(Cl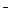 )=1:1;最终溶液中c(A13+):c(Mg2+):c(C1
)=1:1;最终溶液中c(A13+):c(Mg2+):c(C1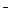 )=1:1:12。
)=1:1:12。
本题难度:一般