1、选择题 化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
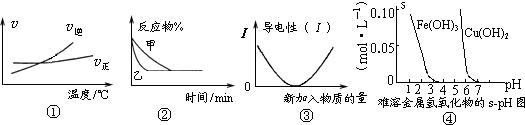
A.根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
2、选择题 下列变化能加快反应速率,且反应物活化分子百分数增加的是
①?升高温度 ②使用证催化剂? ③增大压强? ④增加浓度
A ②④? ?B? ③④?C? ①② ?D ②③
?B? ③④?C? ①② ?D ②③
3、选择题 等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4,下列图中表示其产生H2总体积(V)与时间(t)的关系正确的是(? )

4、选择题 对于可逆反应:aA(g)+bB(g) mC(g)+? nD(g);△H<0,下列说法正确的是
mC(g)+? nD(g);△H<0,下列说法正确的是
A.浓度改变平衡必移动
B.增大压强平衡必移动
C.升高温度平衡必移动
D.导入氦气平衡必移动
5、填空题 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法

(1)已知:
2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+ C(s)= Cu2O(s)+CO(g);△H =_________kJ·mol-1
(2)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:该电池的阳极反应式为___________________

(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________
(4)在相同的密闭容器中,用以上三种方法制得的Cu2O分别进行催化分解水的实验:
 ?△H>0 水蒸气的浓度随时间t变化如下表所示。
?△H>0 水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1·min-1
C.实验②比实验①所用的催化剂催化效率高