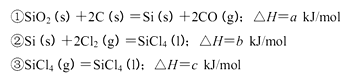1、填空题 阅读下列资料,回答问题:
“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。 工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,二者的体积比约为 1:1。 已知:1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出 286 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式_____________。若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 ___________(填“>”“=”或“<”)890 kJ。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为 _____________;燃烧生成的CO2的质量比约为________________。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是_________________。
参考答案:(1) 2H2(g)+O2(g)=2H2O(l) △H= -572kJ/mol? ;<
(2)3:1? ;3:2
(3)燃烧热值高,CO2的排放量少,有利于环境保护
本题解析:
本题难度:一般
2、选择题 已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
参考答案:
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( ? )
A.甲烷的标准燃烧热为-890.3KJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3KJ?mol-1
B.500℃,30Mpa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3KJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6KJ?mol-1
2NH3(g)△H=-38.6KJ?mol-1
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
参考答案:C
本题解析:
本题难度:简单
4、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(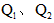 均为正值):
均为正值):

|
有关上述反应的叙述正确的是
[? ]
A.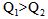
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出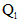 热量
热量
D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
参考答案:AD
本题解析:
本题难度:一般
5、简答题 (14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是
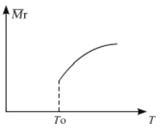
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低