1、填空题 (6分)红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4 ( 白s )+ 5O2 ( g )= P4O10( s ) △H =" -2983.2" kJ/mol
P(红 s )+ 5/4O2 ( g )= 1/4P4O10( s ) △H =" -738.5" kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
参考答案:(6分)P4(s)=4P(s) △H=-29.2 kJ/mol,稳定;
本题解析:由盖斯定律,第一个热化学方程式减去4倍第二个热化学方程式得,P4 ( 白s )=P(红 s ) △H=" -2983.2" kJ/mol-(-738.5 kJ/mol)×4=-29.2 kJ/mol,由此可知,白磷具有的能量高,红磷比白磷稳定。
考点:热化学方程式的书写
本题难度:一般
2、选择题 SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:断裂 1molS
参考答案:
本题解析:
本题难度:一般
3、简答题 科学家要研究跟碳元素及其化合物相关的很多课题.
(1)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量,该反应的热化学方程式是______.
(2)工业上可用焦炭冶炼金属,若0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,则该反应的化学方程式是______.
(3)碳跟水蒸气制水煤气的反应是一个可逆反应,下列情况下能判断该反应一定达到平衡状态的是______(选填编号).
a.v正(H2O)=v正(H2) b.容器中温度不再发生改变
c.消耗n mol H2同时消耗n mol CO d.容器中气体的总物质的量不随时间改变
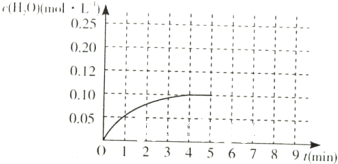
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0mol CO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应[C(s)+H2O(g)?CO(g)+H2(g)]的平衡常数的数值为______.在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,请在如图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线(只要求定性表示).
参考答案:(1)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ?mol-1;
(2)0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,气体为CO2、CO,令生成CO2、CO的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.5,根据电子转移守恒有4x+2y=0.6×3,联立解得x=0.4、y=0.1,CO2、CO的系数为4:1,故该反应的方程式为5C+3Fe2O3高温.4CO2↑+CO↑+6Fe,
故答案为:5C+3Fe2O3高温.4CO2↑+CO↑+6Fe;
(3)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ?mol-1,
a.v正(H2O)=v正(H2),依据反应可知自始至终v正(H2O)=v正(H2),不能说明反应到达平衡,故a错误;
b.反应是吸热反应,容器中温度不变,说明反应达到平衡,故b正确;
c.根据反应可知,消耗n mol H2同时消耗n mol CO,反应逆向进行不能说明反应到达平衡,故C错误;
d.反应前后气体的物质的量发生变化,随反应进行气体的物质的量增加,容器中气体的总物质的量不随时间改变,说明反应到达平衡,故d正确;
故选:bd;
(4)温度T1时,在一体积为2L的密闭容积中,加入2.0mol CO和2.0mol的H2,反应中c(H2O)的变化情况如图所示,
C(s)+H2O(g)?CO(g)+H2(g)
起始量(mol/L) 0 0 1 1
变化量(mol/L) 0.1 0.1 0.1
平衡量(mol/L) 0.1 0.9 0.9
T1时反应C(s)+H2O(g)?CO(g)+H2(g)的平衡常数=0.9×0.90.1=8.1;
在第5分钟时将体系的温发升高到T2,若在第8分钟时达到新的平衡,在反应是吸热反应升温平衡正向进行,水的浓度减小,如图中画出第5分钟到9分钟后c(H2O)浓度变化趋势的曲线为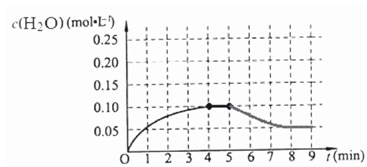 ,
,
故答案为:8.1; .
.
本题解析:
本题难度:一般
4、填空题 (热值指在一定条件下每克物质完全燃烧所放出的热量,燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据.
| 物质 | H2 | CO | CH4
|
| 热值/kJ?g-1 | 143 | 10 | 56
|
(1)根据以上热值数据,最理想的燃料是______.
(2)根据以上热值数据,写出在该状态下表达氢气燃烧热的热化学方程式______.
(3)若管道煤气(含体积比为1:1的H2和CO)价格为1.00元/m3,天然气的价格为2.50元/m3,使用哪种气体在经济上更为合算?______?理由是______.(无需写出计算过程)
参考答案:(1)由表中数据可看出H2的热值最大,且H2为绿色能源,无污染,是最理想的燃料,故答案为:H2;
(2)由表中数据可知,1gH2燃烧放出的热量为143kJ,则1molH2放出的热量为:2×143kJ=286kJ,
所以氢气燃烧热的热化学方程式为H2(g)+12O2(g)=H2O(1);△H=-286kJ?mol-1,
故答案为:H2(g)+12O2(g)=H2O(1);△H=-286kJ?mol-1;
(3)设花费相同的价格的燃料,为都2.5元,
则花费2.5元管道煤气放出的热量为:
500L22.4L/mol×2g/mol1g×143kJ/g+500L22.4L/mol×28g/mol1g×10kJ/g=7009kJ;
花费2.5元天然气放出的热量为:1000L22.4L/mol×16g/mol1g×56kJ/g=40000kJ,
则消费相同价格的燃料时天然气放出的热量多,更合算,
故答案为:天然气;相同价格的管道煤气和天然气相比产生的热量后者多.
本题解析:
本题难度:一般
5、填空题 按要求写热化学方程式:
(1)已知稀溶液中,1?mol?H2SO4与NaOH溶液恰好完全反应时,放出114.6?kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式________________________________。
(2)25℃、101?kPa条件下充分燃烧一定量的丁烷气体放出热量为Q?kJ,经测定,将生成的
CO2通入足量澄清石灰水中产生25?g白色沉淀,写出表示丁烷燃烧热的热化学方程式__________________________________。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)?ΔH1=-870.3?kJ/mol
②C(s)+O2(g)===CO2(g)?ΔH2=-393.5?kJ/mol
③H2(g)+1/2O2(g)===H2O(l)?ΔH3=-285.8?kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式 _______________________________________。
参考答案:(1)1/2H2SO4(aq)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH=-57.3?kJ/mol
(2)C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(l) ΔH=-16?Q?kJ/mol
(3)2C(s)+2H2(g)+O2(g)===CH3COOH(l)?ΔH=-488.3?kJ/mol
本题解析:
本题难度:一般