1、填空题 (1)已知:2SO2(g)+O2(g)?2SO3?(g)△H=-196.6kJ?mol-1;2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1 .则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1
一定条件下,将NO2与SO2?按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______.
a.体系压强保持不
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
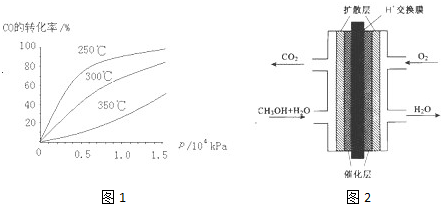
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H______0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______
(3)甲醇(CH3OH)燃料电池的结构示意图如图2.甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
(4)101kPa时,若16gCH3OH完全燃烧生成液态水,放出热量为363.25kJ/mol,则甲醇燃烧的热化学方程式为______.
参考答案:(1)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ?mol-1,则NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;
a、本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;
b、随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;
c、SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;
d、d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据;故选b;
故答案为:-41.8;b;
(2)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强,
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,氧气再正极上得到电子发生还原反应在酸溶液中生成水,反应的电极反应为:O2+4H++4e-═2H2O,
故答案为:负;?O2+4H++4e-═2H2O;
(4)101kPa时,若16gCH3OH物质的量为0.5mol,完全燃烧生成液态水,放出热量为363.25kJ/mol,则1mol甲醇燃烧放热726.5KJ;反应的热化学方程式为:CH3OH(l)+3/2?O2(g)═CO2(g)+2H2O(l)△H=-726.5?kJ/mol,
故答案为:CH3OH(l)+3/2 O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol.
本题解析:
本题难度:一般
2、选择题 下列有关热化学方程式的叙述正确的是( ? )
A.已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-893.0kJ/mol,则甲烷的燃烧热为893.0kJ/mol
B.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g?NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+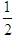 H2SO4(aq)=
H2SO4(aq)=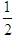 Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol
Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol
D.己知C(s)+O2(g)=CO2(g)△H1,C(s)+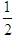 O2(g)=CO(g)△H2,则△H1>△H2
O2(g)=CO(g)△H2,则△H1>△H2
参考答案:C
本题解析:
本题难度:一般
3、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+
O2(g)CO2(g)+2H2O(l)△H=+725.8kJ/mol
B.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l)△H=-1452kJ/mol
C.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l)△H=-725.8kJ/mol
D.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l)△H=+1452kJ/mol
参考答案:B
本题解析:
本题难度:简单
4、选择题 胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,
1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出
890.3 kJ的热量。下列热化学方程式书写正确的是
[? ]
A.CH4(g)+2O2(g)====CO2(g)+2H2O(l);ΔH=+890.3 kJ·mol-1
B.CH4(g)+2O2(g)====CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
D.2H2(g)+O2(g) ====2H2O(l);ΔH=-285.8 kJ·mol-1
参考答案:B
本题解析:
本题难度:简单
5、选择题 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为
[? ]
A.C + H2O == CO + H2? ΔH== +131.3kJ/mol
B.C(s)+ H2O(g) == CO(g) + H2(g)?ΔH== +10.94kJ/mol
C.C(s)+ H2O(l) == CO(g) + H2(g)? ΔH== +131.3kJ/mol
D.C(s)+ H2O(g) == CO(g) + H2(g)?ΔH==? +131.3kJ/mol
参考答案:D
本题解析:
本题难度:简单