1、实验题 某课外小组对一些金属单质和化合物的性质进行研究。下表为“铝与氯化铜溶液反应”实验报告的一部分:
?
| 实验步骤
| 实验现象
|
Ⅰ
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。充分反应后,过滤。
| 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。
|
Ⅱ
| 滤液中加入少量的NaOH溶液。
| 有白色沉淀产生。
|
Ⅲ
| 将所得红色固体用蒸馏水洗涤后,加热烘干。
| 少量红色固体变黑
|
Ⅰ反应的离子方程式 ??,
Ⅱ反应的离子方程式 ??,
Ⅲ反应的化学方程式 ??。
参考答案:
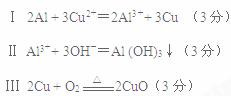
本题解析:略
本题难度:简单
2、简答题 某同学为了验证氢气还原氧化铜的反应产物,设计了如图所示的实验装置.
(1)写出编号仪器的名称:①______,②______.
(2)浓硫酸的作用是______.
(3)本实验需要加热的装置为______(填字母编号).
(4)写出装置C、D中可观察到的现象:C______,D______.
(5)D中反应每生成1个水分子,转移的电子数为______.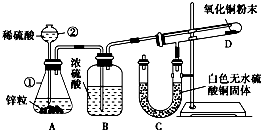
参考答案:(1)熟悉常见化学仪器,了解名称.图中①锥形瓶②长颈漏斗,故答案为:锥形瓶;长颈漏斗;
(2)氢气可用浓硫酸干燥,故答案为:干燥氢气;
(3)还原氧化铜的实验需要在高温下才可以进行,所以需要加热的装置字母编号为D,故答案为:D;
(4)C处得无水硫酸铜因吸水,由白色变为蓝色;D处得黑色氧化铜粉末在加热的条件下,被氢气还原成红色铜.颜色变化是由黑色变为红色.故答案为:白色固体变蓝;黑色粉末变红色;
(5)在反应CuO+H2?△?.?Cu+H2O中,化合价升高值=化合价降低值=转移电子数=2.故答案为:2.
本题解析:
本题难度:一般
3、选择题 下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 (?)

A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液不褪色
C.③中石蕊溶液变蓝色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
参考答案:A
本题解析:在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不正确;SO2为酸性气体,溶于水显酸性,能使石蕊溶液变红色,故C不正确;铜与浓硫酸的反应Cu+2H2SO4 ?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
点评:该题是中等难度的试题,试题基础性强,紧扣教材,意在巩固学生的基础,提高学生的实验分析和探究能力,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意二氧化硫的酸性和漂白性。
本题难度:简单
4、实验题 氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去)。回答下列问题:

(1)写出氨气与氧化铜反应的化学方程式:?。
(2)在A的锥形瓶中放入NaOH固体的目的是?。
(3)在干燥管B中不能选用的干燥剂是?(填序号);
A.碱石灰
B.生石灰
C.五氧化二磷
D.氢氧化钠
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)?。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)?。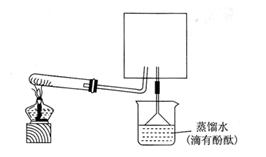
 ??。
??。