| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《盐类水解的原理》考点特训(2019年冲刺版)(二)
参考答案:C 本题解析:Na2S溶液中若S2-不水解则有c(Na+)=2c(S2-),S2-水解浓度减小,故有c(Na+)>2c(S2-),选C。 本题难度:一般 2、选择题 在Na2S溶液中c(Na+)与c(S2-)的比值是 |
参考答案:C
本题解析:
若S2-不水解,则c(Na+)与c(S2-)的比值等于2。但在实际Na2S溶液中,S2-容易水解(分步水解): S2-+H2O HS- +OH-,HS-+ H2O
HS- +OH-,HS-+ H2O H2S+OH- ,所以c(Na+)与c(S2-)的比值大于2。
H2S+OH- ,所以c(Na+)与c(S2-)的比值大于2。
考点:考查盐类的水解
点评:本题考查了盐类的水解,离子浓度大小的比较,难度不大。解题时注意S2-水解,导致c(S2-)比c(Na+)的1/2还要小。
本题难度:一般
3、选择题 0.1 mol?L-1 KHS溶液中下列表达式不正确的是
A.c(K +)+c(H+)=" c(OH-)+" c(HS-)+2 c(S2-)
B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)
C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol?L-1
D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
参考答案:B
本题解析:KHS溶液中,水解程度大于电离程度,所以溶液显碱性,因此c(K+)> c(HS-)> c(OH-)> c(H+)> c(S2-),B不正确,D正确。A符合电荷守恒,C中符合物料守恒,均正确。答案选B。
本题难度:简单
4、选择题 常温下,有关下列4种溶液的说法正确的是
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
参考答案:D
本题解析:A、盐酸是强酸,氨水是弱碱,因此在浓度相同的条件下,盐酸对水的电离抑制程度大,即由水电离出的c(H+):③<①,A不正确;B、氨水是弱碱,0.1 mol·L-1氨水稀释到原来的100倍浓度是0.001mol/L,其溶液的pH值小于11,B不正确;C、①与③混合,若溶液pH=7,则根据电荷守恒可知溶液中c(NH4+)=c(Cl-),C不正确;D、②与④等体积混合后氨水过量溶液显碱性,因此混合液pH>7,D正确,答案选D。
考点:考查弱电解质的电离、溶液中离子浓度大小比较以及pH计算
本题难度:一般
5、填空题 (1)已知:25℃时,一些弱电解质的电离常数如下:NH3·H2O:1.77×10—5 H2CO3:4.3×10—7(第一步电离)。则:NH4HCO3溶液显 性 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,醋酸体积 (填“>”、“<”、“=”)氢氧化钠溶液体积。
(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,A溶液呈碱性的原因是(用离子方式程式表示)________________
(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: ;有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请您运用所学知识解释
(5)已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15。在AB2、AC均为饱和的混合液中,测得c(B—)=1.6×10—3 mol·L-1,则溶液中c(C2—)为 mol/L。
参考答案:(1)(1分)碱
(2)(1分)中性,(1分)>
(3)(2分)Bn-+H2O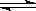 HB(n-1)-+OH-
HB(n-1)-+OH-
(4)Ksp(HgS)<Ksp(FeS);因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水(每空2分,共4分)
(5)(2分)1.83×10—13
本题解析:(1)NH3·H2O:1.77×10—5 H2CO3:4.3×10—7(第一步电离),这说明了碳酸氢根离子的水解程度比铵根离子更加弱,所以其水解程度较大,故NH4HCO3溶液显碱性;2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以得到:c(CH3COO-)+ c(OH-)=c(Na+)+ c(H+),因为c(CH3COO-)=c(Na+),所以 c(OH-)=c(H+),故混合后溶液呈中性,醋酸体积>氢氧化钠溶液体积;(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,说明了B离子发生了水解,其离子方程式为Bn-+H2O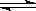 HB(n-1)-+OH-;(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:Ksp(HgS)<Ksp(FeS);FeS作为沉淀剂还可以起到净化水的作用,其原因为因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水;(5)因为Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15,c(B—)=1.6×10—3 mol·L-1,AB2、AC均为饱和的混合液,即c2(B—)c(A—)=4.2×10-8,所以c(A2+)=1.64×10—2mol·L-1,
HB(n-1)-+OH-;(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:Ksp(HgS)<Ksp(FeS);FeS作为沉淀剂还可以起到净化水的作用,其原因为因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附杂质而净化水;(5)因为Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15,c(B—)=1.6×10—3 mol·L-1,AB2、AC均为饱和的混合液,即c2(B—)c(A—)=4.2×10-8,所以c(A2+)=1.64×10—2mol·L-1,
c(C2—)=Ksp(AC)/c(A2+)=3.0×10—15/1.64×10—2=1.83×10—13mol·L-1。
考点:盐类水解、电荷守恒、溶度积的计算
点评:本题考查了盐类水解,电荷守恒、溶度积的计算,这些知识是高考考查的重点和难点,本题有一定的综合性,难度适中。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《原电池原理.. | |