1、计算题 (6分)在500℃容积为2升的密闭容器中充入SO2和O2,其中SO2的浓度为1mol/L,经10秒后,达到平衡,2SO2(g)+O2(g) 2SO3(g),此时容器中SO3的浓度为0.9mol/L,O2的物质的量为2.1mol,试求:① SO2的转化率;② O2的起始浓度(mol/L);③ SO2的平均反应速率(mol/L· min)
2SO3(g),此时容器中SO3的浓度为0.9mol/L,O2的物质的量为2.1mol,试求:① SO2的转化率;② O2的起始浓度(mol/L);③ SO2的平均反应速率(mol/L· min)
参考答案:①90%? ②1.5mol /L? ③ 5.4 mol/L· min
本题解析:2SO2?+? O2? ?2SO3
?2SO3
始c:? 1? 1.5? 0
△c:? 0.9? 0.45? 0.9
平c:? 0.1? 1.05? 0.9
V(SO2)=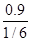 ="5.4" mol/L· min
="5.4" mol/L· min
本题难度:一般
2、选择题 合成氨工业有下列流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为(?)
A.①②③④
B.①③②④
C.④③②①
D.②③④①
参考答案:B
本题解析:对于合成氨工业工艺流程,首先制取原料气,然后在进入合成塔之前,为防止催化剂中毒及动力因素,要对原料气进行净化和压缩。进入合成塔进行合成后,要及时分离出液氨,并进行循环操作,以增强N2和H2的利用率。
本题难度:一般
3、实验题 工业废水中常含有一定量的 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为?

其中第①步存在平衡:?

(1)若平衡体系的pH=2,则溶液显?色.
(2)能说明第①步反应达平衡状态的是?。
a.Cr O
O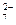
 和CrO
和CrO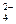 的浓度相同
的浓度相同
b.2v (Cr O
O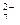 ) ="v" (CrO
) ="v" (CrO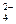 )
)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr O
O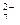 离子,需要?mol的FeSO
离子,需要?mol的FeSO ·7H
·7H O。
O。
(4)第③步生成的Cr(OH) 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
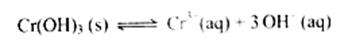
常温下,Cr(OH) 的溶度积
的溶度积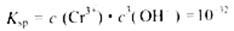 ,要使c(Cr3+)降至10
,要使c(Cr3+)降至10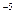 mol/L,溶液的pH应调至?。
mol/L,溶液的pH应调至?。
方法2:电解法
该法用Fe做电极电解含Cr O
O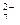 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH) 沉淀。
沉淀。
(5)用Fe做电极的原因为?。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)?。
溶液中同时生成的沉淀还有?。
参考答案:

本题解析:略
本题难度:一般
4、选择题 在密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:
 ,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是

A.上述反应的△H>0
B.压强P1>P2>P3>P4
C.1100℃该反应的平衡常数为64mol2·L-1
D.压强为P4时,在Y点:v(正)<v(逆)
参考答案:A
本题解析:A、由图可知随温度升高CH4的平衡转化率增大,即温度升高平衡正向移动,故反应为吸热反应△H>0,正确;B、由方程式可知压强增大平衡逆向进行,CH4的平衡转化率减小,故P4>P3>P2>P1,错误;
C、? CO2 + CH4 2CO + 2H2
2CO + 2H2
始量? 0.1? 0.1? 0? 0
转化量? 0.08? 0.08? 0.16? 0.16
平衡量? 0.02? 0.02? 0.16? 0.16
平衡常数为k=0.162×0.162÷(0.02×0.02)=1.6384
错误;
D、该点处甲烷的转化率低,平衡应正向移动,v(正)>v(逆),错误。
本题难度:一般
5、选择题 在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应2A(g)+B(g) 2C(g)?△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 (?)
2C(g)?△H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 (?)
A.若反应开始时容器体积为2 L,则υC=0.4mol/L·min
B.若在恒压绝热条件下反应,平衡后nC<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
参考答案:B
本题解析:A.若反应开始时容C的物质的量为零,则υC=0mol/L·min,错误;B.?正反应放热,若在恒压绝热条件下反应,平衡逆向移动,生成的C小于1.6 mol,故平衡后nC<1.6mol;C.反应为不等体积反应,若2min后,向容器中再投入等物质的量A、C,相当于缩小体积增加压强,平衡正向移动,B的转化率增加,错误;D.若该反应在恒温恒容下进行,相当于在恒温恒压下增大容器体积,平衡逆向移动,放出热量将减小。
本题难度:一般