1、选择题 下列说法正确的是

[? ]
A.?把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol·L-1。该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.?将54.4g铁粉和氧化铁的混合物中加入4.0mol/L?200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况)。反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.?现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D.?某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+ 、Al3+ 、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如上图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+ 、Al3+
参考答案:B
本题解析:
本题难度:一般
2、选择题 在恒容密闭容器中有可逆反应:nA(g) + mB(g) 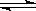 ?pC(g)? m+n>p,(正反应吸热)处于平衡状态,对该平衡的下列说法正确的是
?pC(g)? m+n>p,(正反应吸热)处于平衡状态,对该平衡的下列说法正确的是
A.升高温度,c(B)/c(C)的比值减小
B.加入B,A和B的转化率均增大
C.充入C,A和B的物质的量浓度增大,达到平衡时A的质量百分含量减小
D.降温时,混合气体的平均相对分子质量增大
参考答案:A
本题解析:A正确;B错,加入B,A的转化率均增大,B的转化率减小;C错,充入C,A和B的物质的量浓度增大,达到平衡时A的质量百分含量增大;D错,.降温时,平衡向逆反应方向移动,混合气体的平均相对分子质量减小;
本题难度:一般
3、选择题 某温度下,反应2A(g)
?B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表( )
| 物质 | A(g) | B(g) | C(g)
物质的量/mo1
1.2
0.6
0.6
|
下列说法正确的是.
A.反应前20s的平均速率为v(A)=0.6mo1.L-1?S-1
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
参考答案:依据化学反应的三段式列式计算,
? 2A(g)常温
本题解析:
本题难度:简单
4、填空题 (16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号)?。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
?
①反应的平衡常数表达式为K=?。由上表数据判断,该反应的△H?0(填“>”、“=”或“<”)。升高温度,正反应速率?(填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为?,此时的温度为?。
(3)欲提高CO的转化率,可采取的措施是?。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
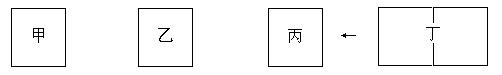
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
| 丙
|
投料方式
| 1molCO、2molH2
| 1molCH3OH
| 2molCH3OH
|
平衡数据
| C(CH3OH)/(mol/L)
| c1
| c2
| c3
|
体系压强(Pa)
| p1
| p2
| p3
|
反应的能量变化
| akJ
| bkJ
| ckJ
|
原料转化率
| α1
| α2
| α3
|
?
下列分析正确的是?。(填序号)
A.2c1<c3?B.2 p1<p3?C.|a|+|b|=90.8? D.α1+α3>1
参考答案:
(1)BD(答对一个给1分)
(2)①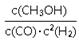 ?<?增大
?<?增大
②80%? 250℃
(3)DF(答对一个给1分)
(4)AC(答对一个给1分,见错不给分)
本题解析:(1)A、同一方向,错误;B、反应中气体的总物质的量变化,气体的质量不变,所以相对分子质量是变量,当不变时达到平衡,正确;C、密度是定值,错误;D、气体的压强与物质的量成正比,压强是变量,当不变时达到平衡,正确。(2)温度升高,K变小,反应放热;升高温度正逆反应速率均增大;通过平衡计算的三步法直接计算可得;(3)A、升温平衡逆向移动,转化率降低,错误;B、催化剂不改变平衡状态,错误;C、加入CO,其转化率降低,错误;D、加入氢气,增加CO转化率,正确;E、恒容条件下通入不反应的气体不能不移动,错误;F、降低生成物浓度,平衡正向移动,反应物转化率提高,正确;
(4)根据题意,把丙设置为丁,则甲乙丁为等效平衡,把丁压缩到一个容器中,增大压强,平衡向生成甲醇的方向移动,故有2c1<c3 ,压强2 p1>p3;甲乙是从两个不同方向进行到同一个平衡,故有
|a|+|b|=90.8 ,α1+α2 =1,丙中甲醇转化率小,故有α1+α3<1。
本题难度:困难
5、选择题 可逆反应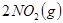

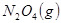 ,△H
,△H 。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
A.增大容器体积
B.温度压强不变,充入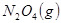
C.温度压强不变,充入
D.容器容积不变,升高温度
参考答案:C,D
本题解析:A. 增大容器体积,各物质的浓度都减小,颜色会变浅。B. 温度压强不变,充入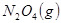 ,容器体积增大,
,容器体积增大,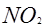 的浓度会减小,颜色变浅。C项,温度压强不变,充入
的浓度会减小,颜色变浅。C项,温度压强不变,充入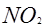 ,
,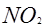 的浓度会变大,颜色变深。D项,容器容积不变,升高温度,平衡逆向移动,
的浓度会变大,颜色变深。D项,容器容积不变,升高温度,平衡逆向移动,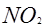 的浓度会变大,颜色变深
的浓度会变大,颜色变深
本题难度:一般