1、选择题 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)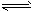 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
|

下列说法正确的是
[? ]
A.反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
参考答案:BC
本题解析:
本题难度:一般
2、选择题 容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g) xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是

A.该反应的x=3
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间也能提高平衡转化率
D.其他条件不变,向甲容器中再充入0.2 mol C,平衡时A的体积分数增大
参考答案:B
本题解析:A.由图象可知平衡时,甲容器平衡时,A的转化率为 ,乙容器内A的转化率为
,乙容器内A的转化率为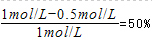 ,甲容器内压强比乙容器内大,增大压强平衡不移动,反应前后气体的体积不变,则x=1+1=2,故A错误;B.温度相同,平衡常数相等,根据B容器计算平衡常数,由图可知A的浓度变化量=0.5mol·L-1,则:
,甲容器内压强比乙容器内大,增大压强平衡不移动,反应前后气体的体积不变,则x=1+1=2,故A错误;B.温度相同,平衡常数相等,根据B容器计算平衡常数,由图可知A的浓度变化量=0.5mol·L-1,则:
A(g)+B(g) 2C(g)
2C(g)
开始(mol·L-1):1? 1? 0
变化(mol·L-1):0.5? 0.5? 1
变化(mol·L-1):0.5? 0.5? 1
故平衡常数k=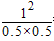 =4,故B正确;升高温度,反应速率加快,缩短到达平衡的水解,平衡向逆反应方向移动,反应物的转化率降低,故C错误;其他条件不变,向甲容器中再充入0.2 mol C,平衡时A的体积分数不变,D错误。
=4,故B正确;升高温度,反应速率加快,缩短到达平衡的水解,平衡向逆反应方向移动,反应物的转化率降低,故C错误;其他条件不变,向甲容器中再充入0.2 mol C,平衡时A的体积分数不变,D错误。
本题难度:一般
3、选择题 已知:N2(g)+3H2(g)  ?2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是 :
?2NH3(g);△H=-Q kJ·mol-1(Q>0)。现有甲乙两个相同的密闭容器,向甲容器中充入1mol N2(g)和3mol H2(g),在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol NH3(g),达到平衡时吸收的热量为Q2 kJ。已知Q2=3Q1,下列叙述中正确的是 :
A.平衡时甲容器中NH3(g)的体积分数比乙容器中的小
B.平衡时甲容器中气体的压强为开始时压强的
C.达到平衡时,甲容器中H2的转化率为25%
D.Q1=Q
参考答案:C
本题解析:温度相同和容器体积相同甲和乙互为等效平衡
甲容器中设N2参加反应xmol则:
N2(g)+3H2(g)  ?2NH3(g);△H=-Q kJ·mol-1
?2NH3(g);△H=-Q kJ·mol-1
起始时的量(moi) : 1? 3? 0?
转化的量(mol) ?:?X? 3x? 2x
平衡时的量(mol): 1-x? 3-3x? 2x
乙与甲互为等效平衡,达平衡时NH3为2xmol
N2(g)+3H2(g)  ?2NH3(g);△H=-Q kJ·mol-1
?2NH3(g);△H=-Q kJ·mol-1
?起始时的量(mol): 0? 0? 2
转化的量(mol): 0.5(2-2x) 1.5(2-2x) 2-2x
平衡时的量(mol):0.5(2-2x) 1.5(2-2x) 2x
放出的热量为:Q2=(2-2X)×Q÷2
则:(2-2X)×Q÷2=3Q÷2×2x
X=o.25?
从以上计算可知,甲和乙为等效平衡NH3(g)的体积分数相同,A错。平衡时甲中物质的量为3.5mol,起始为4mol,比为 7/8,B错。平衡时甲中H2参加反应为0.75mol,起始为3mol,则C对。甲中N2参加反应为0.25mol,则Q1=0.5Q,D错。
7/8,B错。平衡时甲中H2参加反应为0.75mol,起始为3mol,则C对。甲中N2参加反应为0.25mol,则Q1=0.5Q,D错。
本题难度:一般
4、填空题 2010上海世博会成为第一个“低碳世博”。主办方确定以“低碳、和谐、可持续发展的城市”为主题,将大量新能源、节能环保科技成果转化应用于世博会。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是________。(填字母序号)
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O ΔH>0。请在下面的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。

(3)CO2可转化成有机物实现碳循环。在体积为1?L的密闭容器中,充入1?mol?CO2和3?mol?H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0?kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0?kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
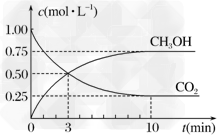
①从3?min到10?min,v(H2)=________mol/(L·min)。
②下列措施中能使 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容再充入1?mol?CO2
C.将H2O(g)从体系中分离
D.恒温恒容再充入1?molCO2和3?mol?H2
E.将CH3OH(g)从体系中分离
F.使用高效催化剂
参考答案:(1)C
(2)  (3)①0.11或
(3)①0.11或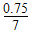 ;②CD
;②CD
本题解析:
本题难度:一般
5、选择题 质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
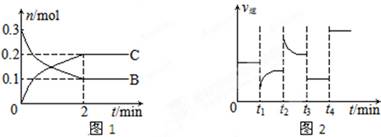
下列有关说法正确的是(?)
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
参考答案:D
本题解析:
【错解分析】错选A或C,错选A,当 x=2时,v(B)=(0.3-0.1)/2="0.1" mol/(L·min);错选C,若增大c(C),反应将向逆反应方向移动,B的物质的量增大,所以B的物质的量分数增大。错选A是没有看清楚图,纵轴表示物质的物质的量,而反应速率的公式中分子是浓度的变化;错选C是模糊了物质的量和物质的量分数之间的关系,物质的量增加并不意味着物质的量分数增加。
【正解】本题主要涉及化学平衡图象的识别和判断,图1是浓度-时间图,图2为速率-时间图,A中,当 x=2时,v(B)=(0.3-0.1)/2/2="0.05" mol/(L·min),B中此反应△H<0,降温平衡正向移动。C中结合图2逆反应速率增大,平衡逆向移动,B的物质量增大,但是总的物质的量也在增大,所以无法确定B的物质的量分数不一定增大。D项中改变压强,平衡不移动,使用催化剂,平衡亦不移动。
本题难度:简单