1、选择题 关于化学平衡常数的叙述正确的是…(?)
A.温度一定,一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Qc<Kc,?v(正)<v(逆)
参考答案:AC
本题解析:Kc是温度的函数。平衡常数的表达式与化学方程式的书写方式有关,同一个化学反应,化学方程式书写方式不同,平衡常数不同,正、逆反应的平衡常数互为倒数。如:H2(g)+I2(g)2HI(g),K正=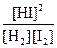 ,K逆=
,K逆=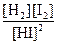 ,所以K正=
,所以K正=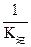 。
。
浓度商Qc<Kc时,反应向正反应方向进行,v(正)>v(逆)。所以A、C正确,B、D错误。
本题难度:简单
2、选择题 在一固定容积的容闭容器中,加入2 L X 和3 L Y 气体,发生如下反应:
n X(g) + 3Y(g)  2Z(g) + R(g),反应平衡时,则知X
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,则化学方程式中的n 值为 (? )
和Y 的转化率分别为30%和60%,则化学方程式中的n 值为 (? )
A.1
B.2
C.3
D.4
参考答案:A
本题解析:略
本题难度:一般
3、选择题 温度、催化剂不变,向某一固定体积的密闭容器内按下列各组物质的量(mol)加入H2、N2、NH3,反应达到平衡时,氨气浓度最大的一组是
[? ]
H2
N2
NH3
A.
6
2
0
B.
1
0
4
C.
3.5
1
2
D.
5?
1.5
1
参考答案:B
本题解析:
本题难度:一般
4、填空题 (本题共8分)
NO和CO都是有毒的气体,利用催化技术能够将它们转变成无毒的CO2和N2。一定量的NO和CO进行如下反应:2NO+2CO 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表:
根据题意回答(均不考虑温度变化对催化剂催化效率的影响):
1.若把化学方程式写为NO+CO CO2+1/2N2,则100℃时,K的值=?。
CO2+1/2N2,则100℃时,K的值=?。
2.上述反应达到化学平衡后,下列措施能提高NO转化率的是________。
A.选用更有效的催化剂? B.升高反应体系的温度
C.降低反应体系的温度? D.缩小容器的体积
3.若上述反应在容积不变的密闭容器中进行,该可逆反应达到平衡的标志是____
A.气体的密度不再变化
B.单位时间内消耗的CO与生成的CO2的物质的量之比为1︰1
C.气体的压强不再变化
D.各气体的浓度相等
4.某温度下,将0.02 mol的NO和0.02 mol的CO的混合气体充入一装有催化剂的容器中,充分反应后,测得混合气体中CO的体积分数为0.125,则CO的转化率为?。
参考答案:(共8分)
1、1.60(2分)2、BD(2分)3、C(2分)4、80%(2分)
本题解析:(1)由平衡常数的表达形式可知K= =1.6
=1.6
(2)能提高NO转化率也就是使平衡正向移动。由于反应是一个体积系数减小的可逆反应,故加压或缩小容器体积可以达到目的;再由表格数据可看出,随着温度的升高,K增大,说明平衡正向移动,为吸热反应。故答案为BD
(3)A:恒容情况下,气体的总质量不变,所以密度也是定值班,不能做为平衡判断标准
B:选项只描述为两个正反应速率,排除
C:题设条件下,随着反应的进行,气体的总物质的量是个变量,只有当达到平衡时,才不变,故可为平衡的判断标准
D:各气体的浓度相等,只是一个“特例”,并不能说明任何问题
(4)由“三段式”可容易计算
本题难度:一般
5、选择题 下列关于平衡移动的说法不正确的是(? )
A.当v(正)=v(逆)时,平衡不移动
B.当v(正)>v(逆)时,平衡向正反应方向移动
C.当v(正)<v(逆)时,平衡向正反应方向移动
D.反应速率发生改变,平衡不一定发生移动
参考答案:C
本题解析:当v(正)>v(逆)时,单位时间内反应物消耗的多、生成的少,生成物生成的多、消耗的少,反应正向移动。同理,当v(正)=v(逆)时,平衡不移动;当v(正)<v(逆)时,平衡逆向移动。当v(正)、v(逆)扩大或缩小相同倍数后,正、逆反应速率相等,平衡不移动。
本题难度:简单