1、填空题 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
参考答案:(8分) (每空2分)
(1)c(NH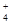 )>c(SO
)>c(SO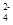 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
(2)HCO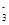
 H++CO
H++CO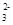 ;HCO
;HCO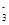 +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;
(3)②①③ ;? 6×10-10mol·L-1
本题解析:(1)铵根离子水解,溶液呈酸性,c(H+)>c(OH-),.1mol?L-1的(NH4)2SO4溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3+H2O H2CO3+OH-,电离平衡为:HCO3-
H2CO3+OH-,电离平衡为:HCO3- H++CO32-;水的电离平衡,H2O
H++CO32-;水的电离平衡,H2O H++OH-。
H++OH-。
(3)Ksp=1.8×10-10mol2?L-2=C(Ag+)?C(Cl-),通过计算分别得到:①100mL蒸馏水中含银离子浓度和氯离子浓度相同;②100mL 0.2mol?L-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,氯离子浓度=1.8×10-10÷0.2=9×10-10mol/L;③100mL 0.1mol?L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度 =6×10-10mol/L;④100mL 0.1mol?L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为:②①④③;②中氯离子的浓度9×10-10 mol/L;,③中银离子的浓度:6.0×10-10mol/L。
点评:本题考查了盐类水解的应用,溶液中离子浓度大小的比较,溶液中平衡的分析,溶液配制,溶度积的计算应用。
本题难度:一般
2、选择题 反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
[? ]
A.0.1s
B.2.5s
C.5s
D.10s
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列事实,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+
C.选择合适的催化剂可使水在较低温度下分解
D.滴有酚酞的Na2CO3溶液,加热后颜色变深
参考答案:C
本题解析:A可以,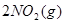 ?
?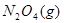 加压,二氧化氮浓度增大,即颜色加深,同时,由于增大压强,平衡将向正反应方向移动,颜色将变浅;B可以,FeS在溶液中存在如下可逆过程:
加压,二氧化氮浓度增大,即颜色加深,同时,由于增大压强,平衡将向正反应方向移动,颜色将变浅;B可以,FeS在溶液中存在如下可逆过程: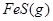 ?
?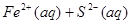 投入Cu2+的废水中,Cu2+能与S2—反应生成更难溶于水的沉淀,从而破坏FeS的溶解平衡;C不能,催化剂不影响平衡的移动,只能改变反应速率;D可以,Na2CO3溶液存在如下水解平衡:
投入Cu2+的废水中,Cu2+能与S2—反应生成更难溶于水的沉淀,从而破坏FeS的溶解平衡;C不能,催化剂不影响平衡的移动,只能改变反应速率;D可以,Na2CO3溶液存在如下水解平衡: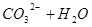 ?
?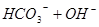 ,加热,平衡将向右移动,溶液碱性加强,即滴有酚酞的Na2CO3溶液,加热后颜色变深;
,加热,平衡将向右移动,溶液碱性加强,即滴有酚酞的Na2CO3溶液,加热后颜色变深;
本题难度:一般
4、填空题 (10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g) + B(g) ?3C(g) +
?3C(g) + D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
D(s),2分钟反应达到平衡,此时C的浓度为1.2mol·L-1。
(1)写出该反应平衡常数的表达式?,
2分钟内B 的平均反应速度为?
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,
则正反应为?(填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1L,反应达到平衡时C的浓度为?mol·L-1,
平衡常数?(填“增大”、“减小”或“不变”)。
参考答案:(10分)(每空2分)
(1)K=[c(C)] 3/[c(A)] 2?[c(B)]?v=0.2mol·(mol·L-1)—1
(2)吸热?
(3)2.4 mol·L—1?不变
本题解析:略
本题难度:一般
5、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  ?2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
?2NH3(g)+ 92.4 kJ。实验测得起始、平衡时的有关数据如下表:
容器编号
| 起始时各物质的物质的量/mol[]
| 平衡时反应中的能量变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量a kJ
|
②
| 2
| 3
| 0
| 放出热量b kJ
|
③
| 2
| 6
| 0
| 放出热量c kJ
|
下列叙述正确的是?
A.反应的平衡常数:③>①>②? B.达到平衡时氨气的体积分数:①>③
C.放出的热量(kJ):a<b<92.4? D.反应得到1mol NH3(l),放出热量46.2kJ
参考答案:C
本题解析:平衡常数只与温度有关系,所以三个容器中的平衡常数相同,A不正确。③相当于在①的基础上缩小容器的弱碱,平衡向正反应方向移动,所以达到平衡时氨气的体积分数是③>①,B不正确。反应是可逆反应,所以①②中不可能生成1mol氨气。②增大氢气的浓度,通过氮气的转化率,所以选项C正确。生成1mol氨气时放热46.2kJ,而不是液氨,D不正确。答案选C。
本题难度:一般