|
|
|
高中化学知识点总结《常见的化学电源》考点预测(2019年强化版)(二)
2019-05-30 02:42:52
【 大 中 小】
|
1、选择题 如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2SO42-=2PbSO4+2H2O.下列有关说法正确的是( )
A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M连接时,所用电源的a极为负极
D.K与M相接时,阳极附近的pH逐渐增大
| 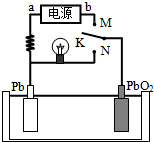
参考答案:A、K与N相接时,是原电池,Pb做负极,PbO2做正极,能量变化为化学能转化为电能,故A错误;
B、K与N相接时,是原电池,Pb做负极,PbO2做正极,氢离子移向正极,故B错误;
C、K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的负极,故C正确;
D、K与M连接时,装置是电解池,阳极是PbO2,电极反应过程中生成氢离子,pH减小,故D错误;
故选C.
本题解析:
本题难度:简单
2、计算题 (8分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,负极反应为_________________________________________
(2)若电解质溶液为硫酸,其正极反应为______________________?,若在常温下转移2mol电子,可产生水质量为_________g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L (标准状况)气体。此时氢氧燃料电池中消耗H2和O2的物质的量各是多少?(写出计算过程)(保留2位小数)
参考答案:(1)? 2 H2-4 e-?+ 4 OH-=4 H2O?(2)? O2+4e-+ 4 H+?= 2 H2O?18 g?
(3)H2和O2的物质的量分别为:0. 15 mol, 0.075 mol
本题解析:(1)负极失去电子,所以电极反应式为2 H2-4 e-?+ 4 OH-=4 H2O。
(2)正极得到电子,所以氧气在正极通入,电极反应式为O2+4e-+ 4 H+?= 2 H2O。每生成1mol水就转移2mol电子,所以是的质量是18g。
(3)考查电解池的有关计算。
阴极生成气体,说明铜离子全部析出,所以反应中转移电子是1mol/L×0.1L×2+1.12L÷22.4L/mol×2=0.3mol。
设消耗H2和O2的物质的量分别为x、y,则根据电子得失守恒可知
2H2?+? O2???2H2O? 4e—
2mol? 1mol? 4mol
x? y? 0.3mol
解得:x="0." 15 mol? y="0.075" mol
本题难度:一般
3、选择题 下图是氢氧燃料电池构造示意图。关于该电池说法中错误的是
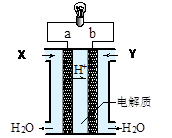
A.a极是负极
B.正极的电极反应是:O2+2H2O+4e- = 4OH-
C.电子由a通过灯泡流向b
D.通入的气体Y为O2
参考答案:B
本题解析:A项:从图中可以看到,H+移向b极,可知b极为负极,a极为正极,故错。C项:电子是由b通过灯泡流向a的,故错。D项:b极为负极,通入的是H2,故错。故选B。
点评:本题考查的是燃料电池的知识,解答本题先从H+的移向入手,在原电池中阳离子移向负极,即可作答本题。
本题难度:简单
4、选择题 LiFePO4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的应用前景。已知该电池放电时的电极反应式为:
正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+,下列说法中正确的是
A.充电时阳极反应为Li++e-=Li
B.充电时动力电池上标注“-”的电极应与外接电源的负极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
参考答案:B
本题解析:充电时电源正极变为阳极,与外接电源的正极相连,A错,B正确;放电时负极:Li-e-=Li+,Li+向正极移动,C错,正极:FePO4+Li++e-=LiFePO4,Li的化合价不变,Fe的降低,故D不正确。
本题难度:简单
5、填空题 (14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
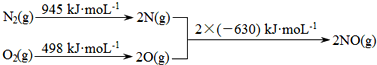
则该反应的热化学方程式为_____________________________。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g);△H= -b kJ?mol-1 CH3OH(g);△H= -b kJ?mol-1
①该反应的平衡常数表达式为_____________________________。
②若容器容积不变,下列措施可增加甲醇产率的是______________
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
|
③经测定不同温度下该反应的平衡常数如下:
温度(℃)
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正___________v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
参考答案:(每空2分共14分)
(1)N2(g)+O2(g)=2NO(g);△H="+183" kJ/moL (2)2.24L
(3)①K=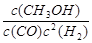
②BD ③<
(4)O2+4e-=2O2- 负
本题解析:(1)根据反应热=反应物的总键能-生成物的总键能,所以氮气与氧气反应的反应热△H=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以该反应的热化学方程式为N2(g)+O2(g)=2NO(g);△H="+183" kJ/moL;
(2)根据2xCO+2NOx ="=" 2xCO2+N2,每生成1mol氮气,则转移电子的物质的量是4xmol,所以转移0.4xmol电子时,生成0.1mol氮气,标准状况下的体积是2.24L;
(3)①根据平衡常数的定义,该反应的平衡常数K=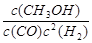
②A、升高温度,平衡逆向移动,甲醇的产率降低,错误;B、将CH3OH(g)从体系中分离,则生成物的浓度减小,平衡正向移动,甲醇的产率增大,正确;C、充入He,使体系总压强增大,但各物质的浓度不变,所以平衡不移动,甲醇的产率不变,错误;D、再充入1 mol CO和3 mol H2,则反应物浓度增大,平衡正向移动,甲醇的产率增大,正确,答案选BD;
③250℃时,Qc=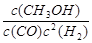 =0.8/0.43=12.5>2.041,则反应逆向进行,所以V正<V逆;
=0.8/0.43=12.5>2.041,则反应逆向进行,所以V正<V逆;
(4)甲醇燃料电池中,甲醇在负极发生氧化反应,氧气在正极发生还原反应,因为电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子,所以正极反应式是O2+4e-=2O2-,在原电池中阴离子向负极移动,所以O2-向负极移动。
考点:考查热化学方程式的书写,化学平衡移动的判断,平衡常数的应用
本题难度:困难

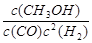
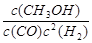
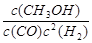 =0.8/0.43=12.5>2.041,则反应逆向进行,所以V正<V逆;
=0.8/0.43=12.5>2.041,则反应逆向进行,所以V正<V逆;