1、选择题 氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列有关叙述正确的是
[? ]
①负极质量减轻 ②负极反应为4OH--4e-=O2↑+2H2O ③负极反应为H2+2OH--2e-=2H2O
④工作时正极区pH升高,负极区pH降低?⑤工作时溶液中阴离子移向正极?
A.①③④
B.②③⑤
C.④⑤
D.③④
2、选择题 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:
2H2+O2=2H2O,下列有关说法正确的是
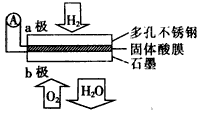
[? ]
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,消耗1.12 L的H2
D. H+由a极通过固体酸电解质传递到b极
3、选择题 镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池.镍氢电池的总反应式是:
?H2+NiO(OH)?
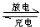
?Ni(OH)2.根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,氢气在正极反应
4、填空题 (12分)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
5、简答题 (14分)目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: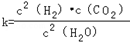 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
容器
| 容积/L
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需的时间/min
|
C(s)
| H2O(g)
| H2(g)
|
甲
| 2
| T1
| 2
| 4
| 3.2
| 8
|
乙
| 1
| T2
| 1
| 2
| 1.2
| 3
|
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8mol?L