|
|
|
高中化学知识点总结《常见的化学电源》考点预测(2019年强化版)(三)
2019-05-30 02:42:52
【 大 中 小】
|
1、填空题 (15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
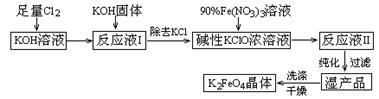
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
2、选择题 LiAl/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-===Li2S+Fe有关该电池的下列说法中,正确的是
A.LiAl在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的总反应式为2Li+FeS===Li2S+Fe
C.负极的电极反应式为Al-3e-===Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS
|
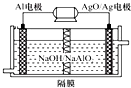
3、选择题 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,下列说法正确的是( )
A.该隔膜是阳离子交换膜
B.当电极上析出1.08?g?Ag时,电路中转移的电子为0.01?mol
C.Al电极的反应式为:Al-3e-+4OH-=AlO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-
|
4、选择题 铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
[? ]
A.蓄电池放电时,每消耗0.1 mol Pb,共生成0.1 mol PbSO4
B.电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小
D.蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大
5、选择题 燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g) + 2H2O(l) + 4e- ="=" 4OH-? y极:2H2(g) + 4OH-- 4e-="=" 4H2O(l) 判断下列说法中正确的是 (? )

A.x极为电池的负极
B.x极附近溶液的pH值减小
C.y极发生氧化反应
D.电流由y极流向x极


