1、选择题 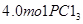 和
和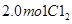 充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)
充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)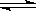 PCl5(g),达平衡时,
PCl5(g),达平衡时, 为0.80 mol,如果此时移走2.0 mol
为0.80 mol,如果此时移走2.0 mol 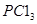 和1.0 mol
和1.0 mol ,在相同温度下再达平衡时,
,在相同温度下再达平衡时, 的物质的量是?(?)
的物质的量是?(?)
A.大于0.40 mol,小于 0.80 mol
B.0.40 mol
C.小于0.40 mol
D.0.80 mol
参考答案:C
本题解析:PCl3(g)+Cl2(g)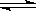 PCl5(g)
PCl5(g)
初始态: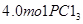 和
和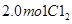 ,达平衡时:
,达平衡时: 为0.80 mol;
为0.80 mol;
“移走2.0 mol 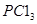 和1.0 mol
和1.0 mol ”,相当于将初始态变为:2.0 mol
”,相当于将初始态变为:2.0 mol 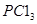 和1.0 mol
和1.0 mol
若平衡不移动,则达平衡时: 应为0.40 mol;但实际上“移走
应为0.40 mol;但实际上“移走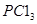 和
和 ”的同时,压强减小,上述平衡将逆向移动,故
”的同时,压强减小,上述平衡将逆向移动,故 的物质的量减小,小于0.40 mol
的物质的量减小,小于0.40 mol
本题难度:一般
2、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
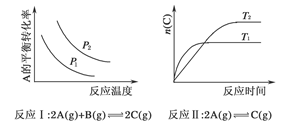
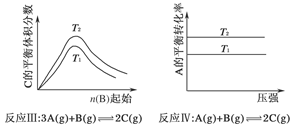
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH<0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1
D.反应Ⅳ:ΔH<0,T2>T1
参考答案:BC
本题解析:本题通过图像设置情况考查外界条件对平衡移动的影响,主要考查考生对平衡移动原理的理解能力及逻辑思维能力和识图能力。反应Ⅰ的特点是正反应方向为气体体积减小的方向,结合图像,压强增大,A的转化率应增大,所以p2>p1,随温度的升高A的转化率减小,所以正反应为放热反应,ΔH<0,故A错。关于反应Ⅱ,由图像可以看出,T1条件下达到平衡所用时间短,所以T1>T2,而在T1条件下达平衡时n(C)小,说明低温有利于C的生成,故它的正反应为放热反应,ΔH<0,B正确;关于反应Ⅲ,由图像可以看出,T2条件下C的平衡体积分数大,因此当T2>T1时正反应应为吸热反应,ΔH>0,而当T2<T1时,正反应应为放热反应,ΔH<0,故C正确;关于反应Ⅳ,由图像可以看出,T2条件下A的转化率大,因此当T2>T1时,说明升高温度平衡向正反应方向移动,因此正反应为吸热反应,ΔH>0,所以D错。
本题难度:一般
3、选择题 对于可逆反应2A(g)+3B(g) 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A.各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B.平衡混合物体积是反应开始前的3/5
C.平衡混合物中各物质的量浓度相等
D.单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
参考答案:D
本题解析:A.各物质的量浓度之比为c(A):c(B):c(C)=2:3:3,只是反应过程中的一种状态,不能确定是否平衡;B.平衡混合物体积是反应开始前的3/5,只是反应过程中的一种状态,不能确定是否平衡;C.平衡混合物中各物质的量浓度相等,只是反应过程中的一种状态,不能确定是否平衡;D.单位时间内,若消耗了a mol A物质,正速率,则同时也消耗了1.5a mol C物质,逆速率,正确。
本题难度:一般
4、选择题 密闭容器中进行的反应为 X(g)+3Y(g) 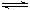 2Z(g),X、Y、Z 的起始浓度依次为0.1 mol/L,0.3 mol/L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是
2Z(g),X、Y、Z 的起始浓度依次为0.1 mol/L,0.3 mol/L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是

A.X=0.2 mol / L
B.Y=0.5 mol  / L
/ L
C.Z=0.3 mol / L
D.Z=0.4 mol / L
参考答案:BC
本题解析:略
本题难度:一般
5、选择题 将2molA和1molB混合装入容积可变的密闭容器中,发生反应:
2A(s)+bB(g)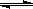 cC(g)
cC(g)
达到化学平衡后,C的物质的量浓度为amol·L—1。若在温度一定的条件下,将密闭容器容积变为原来的1/2后,C的物质的量浓度为2amol·L—1,且始终不变。则b、c关系是(?)
A.b+2="c"
B.b="c"
C.b+2>c
D.b<c
参考答案:B
本题解析:略
本题难度:简单