1、选择题 下列关于化学反应说法中正确的是
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.化学反应速率为0.8 mol /(L·s)是指1s 内生成0.8mol该物质
C.可逆反应达到平衡时,各物质的质量不变,
D.化学反应的限度不可以通过改变条件而改变
2、计算题 (7分)在0.1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达平衡时SO2的浓度;
(2)求30min内的反应速率:v(SO3)、v(O2)、v(SO2)。
(3)求平衡时气体压强与开始时气体压强之比。
3、选择题 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L求:
(1)求该反应的平衡常数。(4分)
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。(4分)
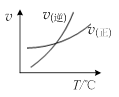
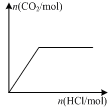
4、选择题 下列图示与对应的叙述相符的是(?)
 ?
? ?
? ?
?
图甲?图乙?图丙?图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
5、选择题 一定条件下,在一密闭容器中将1.0mol·L-1N2与3.0 mol·L-1 H2合成氨,反应到2s时测得NH3的浓度为0.8mol·L-1,当用氨气浓度的增加来表示该反应的反应速率时,该反应的反应速率为
[? ]
A.0.2 mol. (L.s)-1
B.0.4 mol. (L.s)-1
C.0.6 mol. (L.s)-1
D.0.8 mol. (L.s)-1