1、选择题 下列关于化学反应说法中正确的是
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.化学反应速率为0.8 mol /(L·s)是指1s 内生成0.8mol该物质
C.可逆反应达到平衡时,各物质的质量不变,
D.化学反应的限度不可以通过改变条件而改变
参考答案:A
本题解析:
正确答案:A
A.正确,化学键的断裂和形成是化学反应中能量变化的主要原因,化学键的断裂吸收能量,化学键的形成放出能量。
B.不正确,化学反应速率为0.8 mol /(L·s)是指1s 内浓度变化量为0.8mol/L该物质
C.不正确,化学平衡是指在宏观条件一定的可逆反应中,化学反应正逆反应速率相等,反应物和生成物各组分浓度不再改变的状态。
D.不正确,化学反应的限度可以通过改变条件而改变
本题难度:简单
2、计算题 (7分)在0.1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达平衡时SO2的浓度;
(2)求30min内的反应速率:v(SO3)、v(O2)、v(SO2)。
(3)求平衡时气体压强与开始时气体压强之比。
参考答案:(1)0.4mol/L(2分)(2)0.02mol/(L.min),0.01 mol/(L.min),0.02 mol/(L.min)(3分) (3)4:5(2分)
本题解析:略
本题难度:一般
3、选择题 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L求:
(1)求该反应的平衡常数。(4分)
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。(4分)
参考答案:0.25?C(HI)=0.008mol·L-1
本题解析:(1)依题意可知,平衡时[H2]=[I2]=0.0080mol/L,
H2(g) + I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol·L-1)? 0.010?0.010?0
各物质的浓度变化量(mol·L-1)?0.0020?0.0020?0.0040
平衡时各物质的浓度(mol·L-1)?0.0080?0.0080?0.0040
根据平衡常数的概念可得K= C(HI)2/C(H2)C(I2)="(0.0040" mol·L-1)2/(0.0080 mol·L-1)2=0.25?( 4分)
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L
H2(g) + I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol·L-1)?0.02?0.02?0
各物质的浓度变化量(mol·L-1)? x?x?2x
平衡时各物质的浓度(mol·L-1)? 0.02-x? 0.02-x?2x
K=C(HI)2/C(H2)C(I2)=(2x)2/[(0.02-x)×(0.02-x)]="0.25"
解得:x="0.004" mol/L;
故平衡时C(HI)=0.008mol·L-1。?(4分)
本题难度:一般
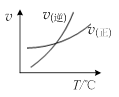
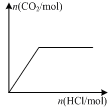
4、选择题 下列图示与对应的叙述相符的是(?)
 ?
? ?
? ?
?
图甲?图乙?图丙?图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
参考答案:B
本题解析:A、图甲中升高温度逆反应速率增大的程度大于正反应速率增大的程度,平衡向逆反应方向进行,这说明正方应是放热反应,因此该反应的ΔH<0,A不正确;B、醋酸是弱酸,存在电离平衡。盐酸是强酸,完全电离,因此稀释pH相同的醋酸和盐酸溶液,盐酸溶液的pH变化程度大,所以图乙中曲线a对应的是醋酸,B正确;C、图丙中反应物的总能量高于生成物的总能量,因此表示该反应为放热反应,但催化剂只能改变活化能,不能改变反应的焓变,C不正确;D、向Na2CO3溶液中逐滴滴加稀盐酸首先碳酸钠转化为碳酸氢钠,然后碳酸氢钠再与盐酸反应生成氯化钠、水和二氧化碳,与图像不符合,D不正确,答案选B。
本题难度:一般
5、选择题 一定条件下,在一密闭容器中将1.0mol·L-1N2与3.0 mol·L-1 H2合成氨,反应到2s时测得NH3的浓度为0.8mol·L-1,当用氨气浓度的增加来表示该反应的反应速率时,该反应的反应速率为
[? ]
A.0.2 mol. (L.s)-1
B.0.4 mol. (L.s)-1
C.0.6 mol. (L.s)-1
D.0.8 mol. (L.s)-1
参考答案:B
本题解析:
本题难度:一般