1、填空题 (12分).已知常温下氯酸钾与浓盐酸反应放出氯气,KClO3 + 6 HCl ="?" KCl + 3Cl2 ↑+3H2O。某校化学活动小组现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的颜色棉球,反应一段时间后,观察出:
(1).对图中指定部位颜色变化为
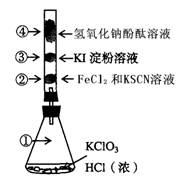
(2).写出②中离子反应方程式_____________________________________.
写出④中离子反应方程式____________________________________________
(3).标出KClO3 +? 6 HCl ="?" KCl + 3Cl2 ↑+ 3 H2O反应中电子转移的方向和数目.
参考答案:(1)(每空1分)
?
①
②
③
④
颜色
黄绿色
红色
蓝色
红色褪色
(2)2Fe2+ +Cl2 = 2Fe3+ +2Cl-
Fe3+ +3SCN- = Fe(SCN)3
Cl2 +2 OH- = Cl- +ClO- +H2O
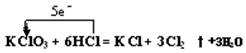
本题解析:略
本题难度:一般
2、选择题 下列物质中同时含有氯分子(Cl2)和氯离子(Cl―)的是?(?)
A.液氯
B.新制氯水
C.CaCl2溶液
D.次氯酸
参考答案:B
本题解析:A错,只有氯气分子,B正确,新制的氯水中有三种分子(氯分子、水分子、次氯酸分子)和四种离子(氯离子、次氯酸根离子、氢离子、氢氧根离子);C错,只有氯离子;D错,次氯酸中既没有氯离子,也没有氯气分子,所以正确的答案选B。
本题难度:一般
3、选择题 以下对实验及现象的叙述错误的是( )
A.氨气能使湿润的蓝色石蕊试纸变红
B.将干燥的氯气通入到湿润的红布条中,红布条褪色
C.往SO2的水溶液中滴入品红溶液,振荡,溶液褪色,经加热后,溶液又变成红色
D.往溴化钾溶液中滴入新制的氯水,溶液呈黄色
参考答案:A、因氨气能使湿润的蓝色石蕊试纸变红,故A正确;
B、因干燥的氯气无漂白性,但遇到水生成次氯酸,次氯酸具有漂白性,所以干燥的氯气通入到湿润的红布条中,红布条不褪色,故B错误;
C、因二氧化硫漂白原理在于能与有机色素结合成无色的不稳定化合物,加热后,无色不稳定的化合物分解,又恢复原来的颜色.所以往SO2的水溶液中滴入品红溶液,振荡,溶液褪色,经加热后,溶液又变成红色,故C正确;
D、新制的氯水能与溴化钾反应:2KBr+Cl2═2KCl+Br2,Br2溶于水,溶液呈橙黄色,故D正确;
故选:B.
本题解析:
本题难度:简单
4、选择题 下列关于Cl2和SO2的说法正确的是( )
A.两者漂白原理相同
B.两者都可用水吸收,减少污染
C.两者都能与碱发生氧化还原反应
D.两者都是有毒气体
参考答案:A.二氧化硫的漂白性是利用二氧化硫和有色物质反应生成无色物质,氯气的漂白原理是:氯气和水反应生成次氯酸,次氯酸具有漂白性,是利用次氯酸的强氧化性进行漂白,所以二者漂白原理不同,故A错误;
B.二氧化硫和氯气都有毒,1体积水溶解2体积氯气,1体积水溶解40体积二氧化硫,氯气在水中的溶解度较小,所以不能用水吸收,应该用碱液吸收而减少污染,故B错误;
C.二氧化硫和碱反应生成亚硫酸盐,反应中各元素化合价都不变,所以不是氧化还原反应,故C错误;
D.氯气和二氧化硫都是有毒气体,所以不能直接排空,应该用碱液吸收,故D正确;
故选D.
本题解析:
本题难度:一般
5、简答题 新制的氯水含有的分子和离子,现分别做如下实验:将紫色石蕊试液滴入,溶液显红色,起作用的粒子是______.上述溶液逐渐褪去,起作用的粒子是______.加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是______.
参考答案:酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子;
银离子和氯离子能生成不溶于稀硝酸的白色沉淀,所以加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是氯离子.
故答案为:H+;HClO;Cl-.
本题解析:
本题难度:一般