|
高中化学知识点归纳《热化学方程式》高频试题特训(2019年最新版)(四)
2019-05-30 03:17:52
【 大 中 小】
|
1、填空题 甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):
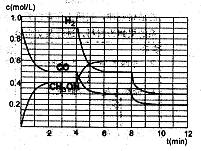
①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
| ②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。

①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
参考答案:化学反应式或方程式未配平的均扣1分
(1)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ/mol (2分,方程式1分,反应热2分,状态错误扣1分,计量数错误不得分。)
(2) ① BD (2分,少选扣1分,有错选不得分)
② 0.4mol/(L·min) 或6.67×10-3 mol·L-1·s-1(2分,无单位不得分)
③ 0.99 (2分,数值在1.0~0.98之间均得分,写成“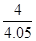 ”或“ ”或“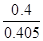 ” 得1分,单位不做要求。) ” 得1分,单位不做要求。)
④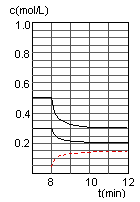
(3)① CH3OH-6e-+H2O=CO2↑+6 H+ (2分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
② 铝制品(1分,写“Al”或“铝”均可,其他书写不得分)
2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O(3分,或“Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+3CO2↑,2Al(OH)3=Al2O3+3H2O”各1分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
本题解析:(1)先写出三种物质的燃烧热的热化学方程式。
① CO(g)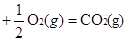 △H1=-283.0kJ/mol △H1=-283.0kJ/mol
② H2(g)+ 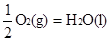 △H2=-285.8 kJ/mol △H2=-285.8 kJ/mol
③ CH3OH(1)+ 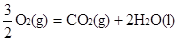 △H3=-726.5kJ/mol △H3=-726.5kJ/mol
再写出目标方程式:CO(g)+2H2(g)=CH3OH(l) △H4
根据盖斯定律, ①+②×2-③即得到目标方程式。 △H4= △H1+△H2×2-△H3=-128.1kJ/mol
根据图像: CO(g)+2H2(g)=CH3OH(l)
起始:(mol/L) 0.9 x 0
0-2min(mol/L) —0.4 —0.8 0.4
2-4min(mol/L)(平衡) 0.5 0.9 0.4
4-6min(mol/L) —0.2 —0.4 0.2
6-8min(mol/L)(平衡) 0.3 0.5 0.6
8-10min(mol/L) —0.1 —0.2 0.1
10-12min(mol/L)(平衡)0.2 0.3 y
①A项,起始时浓度x=C(H2)为1.7mol/L,容器体积未知,所以物质的量也未知,A项错误。
B项,该容器是一个恒容的容器,反应是一个非等体积反应,因此当气体的总物质的量不再改变,即压强不再改变,反应即达到平衡状态,正确。
C项,4min时,平衡向右移,并且各物质的浓度是逐渐变化,所以应该是降温的条件下,C项错误。
D项,7min时,反应再次达到平衡,此时v(CO)=v(CH3OH),D项正确。
②0~2min内平均反应速率v(H2)=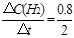 ="0.4" mol·L-1·min-1 ="0.4" mol·L-1·min-1
③在3min时该反应的平衡常数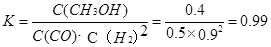
④在第8min时,CO的浓度减少0.1mol·L-1,H2的浓度减少0.2mol·L-1,可知平衡在向右移动,CO和H2的浓度都是逐渐变小,而此时的条件和上次平衡移动的条件不相同,所以只能是减少甲醇的浓度,才能使平衡向右移动,即在平衡移动的瞬间,甲醇的浓度是很少的,应该要低于0.05mol·L-1,然后再增加0.1mol·L-1,在第10min平衡,并且浓度y不超过0.15mol·L-1。
(3)该装置中甲是一个燃料电池装置,给右边的装置乙提供电能,乙装置是一个电解池装置。
①甲中质子移向右边,从而推知甲装置左是负极,右是正极,则乙装置中M是阳极,N是阴极。甲中电池的负极反应式为:CH3OH-6e-+H2O=CO2↑+6 H+ 要注意电解质溶液质子在进行传递。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。则阳极M材料是铝制品,阴极N材料是石墨。在铝表面钝化,即把铝变成Al2O3,同时考虑溶液中溶质为NaHCO3,则电极反应为:2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O
考点: 考查热化学方程式的书写、化学平衡原理及其图像问题、电化学综合。
本题难度:困难
2、填空题 (15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:
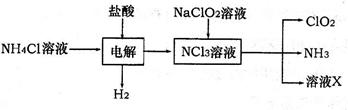
已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。 NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
参考答案:Ⅰ、6(c-b)-2a(2分);
Ⅱ、(1)D(2分),CH4-8e-+10OH-=CO32-+7H2O(2分);O2+2H2O+4e-=4OH-(2分);
(2)①2H++2e-=H2↑(2分);②NH4Cl(NH4+)(2分);③C(1分);④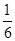 mol(2分)。 mol(2分)。
本题解析:Ⅰ、①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ?mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=bkJ?mol-1
③C(石墨)+O2(g)=CO2(g)△H=ckJ?mol-1
依据盖斯定律(③-②)×6-①×2得到4Fe(s)+3O2(g)=2Fe2O3(s)△H=6(c-b)-2a kJ?mol-1
Ⅱ、(1)设计成原电池需要是自发进行的氧化还原反应;
A.C(s)+CO2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H2O(l)=2H2(g)+O2(g),反应是非自发进行的氧化还原反应,故C不选;
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l),是自发进行的氧化还原反应,可以设计成原电池;故D选;
D反应是甲烷燃料电池,在碱溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应;
负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O;
正极电极反应为:O2+2H2O+4e-=4OH-;
(2)NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价. NCl3+3H2↑;假设NCl3中氮元素为+3价.
①电解时阴极上是氢离子得到电子生成氢气,阴极的电极反应式为:2H++2e-=H2↑;
②电解时阳极上是铵根离子失去电子生成氢气,故答案为:NH4Cl(NH4+);
③A、ClO2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO2,故C正确;
D、ClO2易溶于水,不能利用水吸收氨气,故D错误;
故选:C;
④NCl3与NaClO2恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO2-=6ClO2↑+3Cl-+3OH-+NH3↑,生产过程中,每生成1mol ClO2,需消耗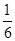 mol,故答案为: mol,故答案为: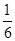 mol。 mol。
考点:考查了热化学方程式和盖斯定律的计算应用,原电池、电解池原理的分析判断,和电极反应书写方法,氧化还原反应计算的分析判断。
本题难度:困难
3、填空题 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
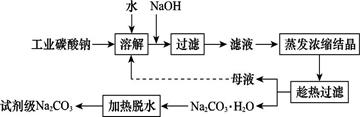
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ.有关物质的溶度积如下
物质
| CaCO3
| MgCO3
| Ca(0H)2
| Mg(OH)2
| Fe(OH)3
| Ksp
| 4.96×10-9
| 6.82×10-6
| 4.68×10-6
| 5.61×10-12
| 2.64×10-39
|
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) Na2CO3(s)+10H2O(g)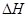 ="+532.36" kJ·mol-1 ="+532.36" kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) Na2CO3·H2O(s)+9H2O(g) 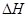 ="+473.63" kJ·mol-1 ="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式: 。
参考答案:
(1)MgCO3+2OH- = Mg(OH)2+ CO32—(书写Fe3++3 OH-=Fe(OH)3↓、Mg2++2 OH-=Mg(OH)2↓不得分)(3分) (3分)(2)Cl-、 (3分)(2)Cl-、 (2分) (2分)
(3)不可行(2分) 若“母液”循环使用,则溶液中c(Cl-)和c( )增大,最后所得产物Na2CO3混有杂质(2分) )增大,最后所得产物Na2CO3混有杂质(2分)
(4)Na2CO3·H2O(s)=Na2CO3(s)+ H2O(g) △H="+58.73" kJ·mol-1 (3分)
本题解析:由溶度积表知,MgCO3的Ksp最大,在溶液中溶解的最多,其它物质与MgCO3相差的数量级较大,在溶液里可以忽略。
(1)主要是MgCO3与NaOH的反应生成Ksp更小的沉淀Mg(OH)2;
PH="8" ,C OH-=10-6 Ksp= c(Mg2+)C2(OH-)= c(Mg2+)10-12 =5.61×10-12 c(Mg2+)=5.61
Ksp= c(Fe3+)C3(OH-)=c(Fe3+)10-18=2.64×10-39 c(Fe3+)=2.64×10-21
c(Mg2+):c(Fe3+)=5.61:2.64×10-21=
(2)母液”中,与CO32—不形成沉淀的只有Cl-、
(4)①Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) Na2CO3(s)+10H2O(g)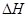 ="+532.36" kJ·mol-1 ="+532.36" kJ·mol-1
②Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) Na2CO3·H2O(s)+9H2O(g) 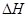 ="+473.63" kJ·mol-1 ="+473.63" kJ·mol-1
①-②得:Na2CO3·H2O(s)=Na2CO3(s)+ H2O(g) △H="+58.73" kJ·mol-1
考点:本题考查Ksp计算、离子共存、盖斯定律等相关知识。
本题难度:困难
4、填空题 在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化示意图如下:

(1)第二步反应是 反应(选填“放热”或“吸热”),判断依据是 。
(2)1 mol NH4+ (aq)全部氧化成NO2- (aq)的热化学方程式是 。
参考答案:(1)放热 ΔH=-73 kJ/mol(或反应的总能量大于生成物的总能量)
(2)NH4+(aq)+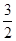 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
本题解析:(1)由题意知,NH4+第一步氧化为NO2-,第二步NO2-氧化为NO3-,第二步反应中,反应物的总能量高于生成物的总能量,故第二步反应为放热反应。
(2)1 mol NH4+全部氧化成NO2-时,放出273 kJ的热量,则反应的热化学方程式为:NH4+ (aq)+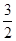 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol。 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol。
本题难度:一般
5、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
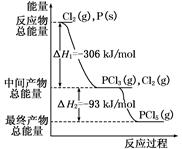
(1)P和Cl2反应生成PCl3的热化学方程式是 ;
(2)P和Cl2分两步反应生成1 mol PCl5的ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”、或“等于”)。
参考答案:(1)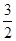 Cl2(g)+P(s)=PCl3(g) ΔH=-306 kJ/mol Cl2(g)+P(s)=PCl3(g) ΔH=-306 kJ/mol
(2)-399 kJ/mol 等于
本题解析:(1)产物的总能量减去反应物的总能量就等于反应热,结合图像可知,PCl3和反应物P和Cl2的能量差值为306 kJ,因此该热化学反应方程式为:
P(s)+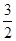 Cl2(g)=PCl3(g) ΔH=-306 kJ/mol。 Cl2(g)=PCl3(g) ΔH=-306 kJ/mol。
(2)根据盖斯定律求得:ΔH3=-399 kJ/mol,且ΔH3=ΔH4,与反应的途径无关,只与起始物质、最终物质有关。
本题难度:一般
| 
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)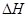 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g) 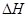 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1