1、选择题 一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)?2Z(g),经60s达到平衡,生成0.4mol Z。下列说法正确的是?(?)
A.60s内反应速率为 (X)=0.05 mol/(L·s),X的转化率为80%
(X)=0.05 mol/(L·s),X的转化率为80%
B.其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的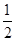
C.其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0
D.其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小
参考答案:D
本题解析:由化学反应方程式可知:
3X(g)+Y(g)?2Z(g)
起始浓度? 1.5? 1.5? 0
变化浓度? 0.3? 0.1? 0.2
平衡浓度? 1.2? 1.4? 0.2
A错,60s内反应速率为 (X)=
(X)=
B错,其它条件不变,将容器体积变为4L,相当于减小反应体系的压强;在这个瞬间Z的浓度变为原来的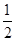 ,随后平衡将向逆反应(气体体积增大)方向移动,再次达到平衡后,Z的浓度会比原来的
,随后平衡将向逆反应(气体体积增大)方向移动,再次达到平衡后,Z的浓度会比原来的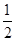 更小。
更小。
C错,其它条件不变,若升高温度,X的体积分数增大,即X的量增多,平衡向逆反应方向移动,即升高温度,平衡向逆反应方向移动,所以该反应的正反应△H<0
D正确,其它条件不变,若初始投入2mol X和2mol Y,相当于压强减小,则物质Y的转化率减小
本题难度:一般
2、填空题 (8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
?回答下列问题:
(1)该反应的化学平衡常数表达式为K=?;
(2)该反应为?反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为?℃;
(4)830℃时,向该容器中加入1L CO2与1L H2?,平衡时CO2的体积分数是?。
参考答案:(1)K=_ _。
_。
(2) _放热_(填“吸热”或“放热”)反应。
(3)减小__(填“增大”、“减小”或“不变”,下同),_增大____。
(4)不移动(填“向左”、“向右”、“不移动”),增大A的浓度 _,__B
本题解析:略
本题难度:一般
3、选择题 对于3W(g) + 2X(g) = 4Y(g) + 3Z(g) ,下列反应速率关系正确的是
[? ]
A.υ(W) =3υ(Z)
B.2υ(X) =3υ(Z)
C.2υ(X) =υ(Y)
D.3υ(W) =2υ(X)
参考答案:C
本题解析:
本题难度:简单
4、选择题 反应aX(g) + bY(g)  ?cZ(g);△H=Q,有下图所示关系,下列判断中正确是(?)
?cZ(g);△H=Q,有下图所示关系,下列判断中正确是(?)

A.a+b < c, Q > 0
B.a+b < c, Q < 0
C.a+b > c, Q > 0
D.a+b > c, Q < 0
参考答案:D
本题解析:观察图可知,P1>P2,T1>T2。如果a+b<c,升高温度和增大压强化学平衡都逆向移动,图像不符合,故A、B项错误。如果a+b > c,根据图像,升高温度,X的量增多,正反应为放热反应,Q < 0,故选D。
点评:本题考查的是化学平衡移动的相关知识,题目难度中等,分析透彻影响化学平衡移动的因素是解题的关键。
本题难度:一般
5、填空题 (每空2分共8分)
向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=?
②.若a=0.7,b=2.1,则:
Ⅰ.c=??.
Ⅱ.这时反应向?进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是?
参考答案:4? 2.6?逆反应方向? 1<c≤4
本题解析:略
本题难度:简单