1、选择题 下列关于平衡常数的说法中,正确的是? ( )。
A.在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示
B.化学平衡常数较大的可逆反应,所有反应物的转化率一定大
C.可以用化学平衡常数来定量描述化学反应的限度
D.平衡常数的大小与温度、浓度、压强、催化剂有关
参考答案:C
本题解析:平衡常数表达式中各物质的浓度都是平衡浓度,平衡常数大小只与反应温度有关,A、D错误;化学平衡的大小可以描述反应进行程度的大小,C正确;对于同一反应,平衡常数越大,反应物转化率越大,但对于不同反应,则无法比较,B错误。
本题难度:简单
2、选择题 在一烧瓶中,在25℃时存在着平衡:2NO2 N2O4;ΔH<0。把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。不会改变的是? (? )
N2O4;ΔH<0。把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。不会改变的是? (? )
A.①和③
B.②和④
C.④和⑤
D.③和⑤
参考答案:D
本题解析:由于反应2NO2 N2O4;ΔH<0正反应方向的特点:气体的系数减小和放热的反应。所以,升高温度,平衡向逆反应移动,①颜色加深;②平均相对分子质量减小;③质量不变;④压强增大;⑤密度不变。
N2O4;ΔH<0正反应方向的特点:气体的系数减小和放热的反应。所以,升高温度,平衡向逆反应移动,①颜色加深;②平均相对分子质量减小;③质量不变;④压强增大;⑤密度不变。
本题难度:一般
3、选择题 下列事实不能用勒夏特列原理解释的是?(?)
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C.过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多。
D.久制的氯水PH值变小。
参考答案:C
本题解析:A.工业生产硫酸的过程中由于SO2转化为SO3的反应是可逆反应,若使用过量的氧气,即增大了反应物的浓度,根据平衡移动原理,增大反应物的浓度,可以是平衡正向移动,因此可以提高二氧化硫的转化率,正确;B.合成氨的反应是气体体积减小的放热反应,工厂通常采用20MPa~50MPa压强,即增大压强,结构平衡移动原理:增大压强,可以使平衡向气体气体减小的方向,即正反应方向移动,因此可以使更多的氮气、氢气合成氨气,因此就可以提高原料的利用率;正确;C.过氧化氢分解加二氧化锰作催化剂,只能提高化学反应速率,但是这与化学平衡的移动无关,错误;D.氯气与水的反应是可逆反应,若氯水久制,HClO发生分解,使平衡正向移动,溶液中的c(H+)增大,所以溶液的PH值变小。正确。
本题难度:一般
4、填空题 (12分)已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得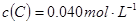 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B)?b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变? d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050mol C,500℃时充分反应达平衡后,吸收热量Q2 kJ,则Q1与Q2之间的关系式可表示为___________________________(用含Q1、Q2的代数式表示)。
(3)500℃时,上述反应的化学平衡常数K=____________________。
(4)已知K(300℃)>K(350℃),该反应是__________(填“放”或“吸”)热反应;若反应温度升高,A的转化率___________________(填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率 与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”)
与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”)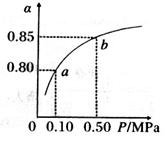
参考答案:
(1)b c
(2)Q1=4Q2
(3)3200L·mol—1
(4)放热?减小
(5)=
本题解析:(1)达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变
a.没有指明速率是正反应速率或逆反应速率,不正确
b.以A、B表明逆反应速率和正反应速率,且数值上符合系数比,正确
c.该可逆反应两边的气体系数不等,气体的总物质的量是个变量,当数值不变时,则一定达到平衡状态,正确
d.在恒容的容器中,气体的总质量为定值,密度为定值,不能做为平衡状态的判定标准,排除
答案为b、c
(2)反应:2A(g)+B(g) 2C(g)
2C(g)
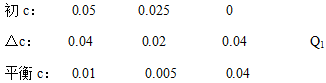
根据等效平衡的概念可知,若在相同的容器中只加入0.050mol C,500℃时充分反应达平衡后,与上述平衡状态完全等效,C的△c为0.01mol/L,对应的热量
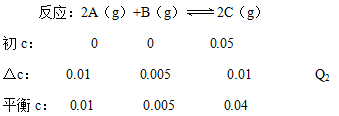
很明显,Q1=4Q2
(3)K= 3200L·mol—1
3200L·mol—1
(4)由知K(300℃)>K(350℃)可知,升温时,平衡左移,A的转化率减小,正反应为放热反应
(5)化学平衡常数只与温度有关,故K(A)=K(B)
本题难度:一般
5、填空题 有两个密闭容器A和B,A容器中有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等量的体积比为2:l的SO2和O2的混合气体,并使A和B容积相等(如图所示),在保持400℃的温度下使之发生如下反应:2SO2+O2 2SO3。填写下列空白:
2SO3。填写下列空白:
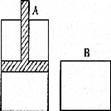
(1 )SO2的转化率α(A)?α(B)。(填“<”、“>”或“=”)
(2)达到(1)所述平衡时,若向两容器中通入少量的氩气,A容器化学平衡?移动。(填“正向”、“逆向”或“不”)
(3)达到(1)平衡后,向容器中充入等量的原反应气体,再次达到平衡后,B容器中SO3在混合气体中的体积分数?。(填“增大”、“减小”或“不变”)
参考答案:(1) ?>? (2)?逆向? (3)?增大
本题解析:(1)?可以先理解为A容器的体积保持不变,二者都达到等效平衡,此时,对于A中物质的量来讲,比原来减小,再让容器体积发生变化,可以理解为对于A来说是增大压强平衡右移,转化率增大,所以有α(A) > α(B)。 (2) 充入少量氩气后,A的体积增大,平衡逆向移动。(3) 达到(1)平衡后,向容器中充入等量的原反应气体,若平衡不移动,三氧化硫的体积分数都不变,但对于B容器来讲,相当于增大压强,平衡右移,致使B容器中SO3在混合气体中的体积分数增大。
本题难度:一般