1、选择题 断定NaHCO3白色粉末中是否混有Na2CO3的方法是( )
A.加热观察是否有气体放出
B.加盐酸并观察生成气体的速度
C.Ba(OH)2溶液,观察有无白色沉淀生成
D.加CaCl2溶液,观察有无白色沉淀生成
参考答案:A、加热碳酸氢钠分解生成二氧化碳,有气体放出,碳酸钠不分解,只能说明含有碳酸氢钠,故A错误;
B、碳酸氢钠与碳酸钠都能与盐酸反应生成二氧化碳,故B错误;
C、碳酸氢钠与碳酸钠都能与氢氧化钡反应生成碳酸钡白色沉淀,故C错误;
D、碳酸钠与氯化钙反应生成碳酸钙白色沉淀,碳酸氢钠不与氯化钙反应,根据是否有无白色沉淀生成,可以判断是否含有碳酸钠,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 下列有关实验操作的叙述正确的是
A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度
B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧
C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出
D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
参考答案:A
本题解析:氯化铁是能够水解的强酸弱碱盐,即FeCl3+3H2O Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
本题难度:简单
3、实验题 某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
⑴甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是?。
⑵乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-的结构式为?。
⑶根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式
??
⑷丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是?__??
⑸通过本次探究,可以得出以下结论,a、用SCN-间接检验Fe2+时应注意?;b、与SCN-反应使溶液变红的?是Fe3+。(填“一定”或“不一定”)
参考答案:(12分)⑴如果是亚铁离子干扰,不可能变红之后,一段时间之后变成蓝色?
⑵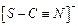 ?
?
⑶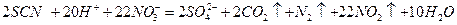
⑷比较硫氰根离子与氯离子、溴离子、碘离子的还原性强弱?
⑸a、加入氧化剂如氯气等必须少量? ? b、不一定
本题解析:略
本题难度:简单
4、简答题 重铬酸钠俗称红矾钠(Na2Cr2O7?2H2O)是重要的化工产品和强氧化剂.工业制备的流程如下:
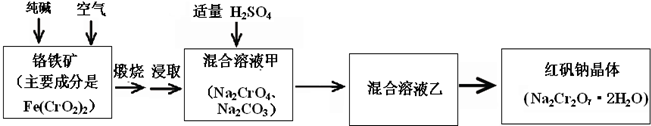
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是______价.
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成______.
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2=2Fe2O3+8Na2CO4+8CO2
为了加快该反应的反应速率,可采取的措施是______.
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+=Cr2O72-+H2O;
3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72-必须除去.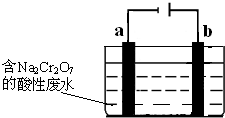
工业上可用电解法来处理含Cr2O72-的废水,如图为电解装置示意图(电极材料分别为铁和石墨).通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去.
a电极的电极反应式是______,b电极附近反应的离子方程式是______.
参考答案:(1)Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价,
故答案为:+2
(2)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(3)增大反应物接触面积可以加快反应速率,升高温度可以大大加快反应速率,
故答案为:粉碎矿石、升高温度;
(4)①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,
故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式Na2Cr2O7和Na2SO4,
故答案为:Na2Cr2O7和Na2SO4;
(5)根据电解槽图示可知,a为阴极,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,
b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:2H++2e-=H2↑,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
本题解析:
本题难度:一般
5、实验题 (9分)有人设计一个Na2O2与CO2反应实验装置图如下:
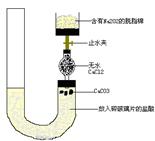 ?
?
打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2与CO2反应的结论是:
a:有氧气生成:b:?
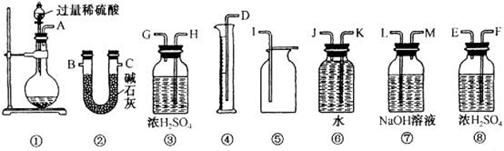
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。
请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①②进行实验,他测得的数据是?。按他测得的数据计算出的实验结果偏高,理由是?。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口 的连接顺序?。?
的连接顺序?。?
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1 g和w2 g,则样品中碳酸钠的质量分数为?。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处??(若没有,此空不必回答;若有,请一并说出不足的理由)? ??。
??。
参考答案:(1)b:该反应是放热反应。(1分)
(2)①调节④⑥液面高度相同(1分)?
②二氧化碳的质量(1分);
气体中的水蒸气被碱石灰吸收,同时空气中的二氧化碳和水蒸气也被碱石灰吸收。(1分)
③A→H→G→B→C→F→E或A→F→E→B→C→H→G(B、C可交换)(2分,见错不给分)
④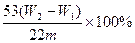 (2分)
(2分)
⑤?有(1分),装置中二氧化碳不能全部被碱石灰吸收(1分)
本题解析:略
本题难度:一般