1、实验题 下图装置测定中和热的实验步骤如下:
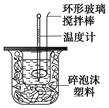
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol)?。
(2)倒入NaOH溶液的正确操作是?(从下列选出)。
A.沿玻璃棒缓慢倒入? B.分三次少量倒入? C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是?(从下列选出)。
A.用温度计小心搅拌? B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
| 温度差平均值(t2-t1)/℃
|
H2SO4
| NaOH
| 平均值
|
1
| 26.2
| 26.0
| 26.1
| 29.5
| ?
|
2
| 25.9
| 25.9
| 25.9
| 29.2
|
3
| 26.4
| 26.2
| 26.3
| 29.8
|
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=?(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)?。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
2、选择题 可用于鉴别氯化钾、盐酸、氢氧化钾三种溶液的试剂是( )
A.紫色石蕊试液
B.AgNO3溶液
C.Na2CO3溶液
D.淀粉碘化钾溶液
3、选择题 已知常温下氯酸钾与浓盐酸反应能放出氯气,现按右下图进行卤素的性质实验。玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
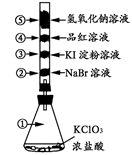
?
| ①
| ②
| ③
| ④
|
A
| 黄绿色
| 橙色
| 蓝色
| 红色
|
B
| 黄绿色
| 橙色
| 蓝色
| 白色
|
C
| 黄绿色
| 无色
| 紫色
| 红色
|
D
| 无色
| 橙色
| 紫色
| 白色
4、实验题 为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验。
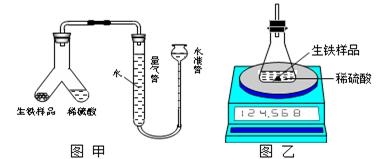
(1)设计如图甲所示装置,使生铁样品与稀硫酸反应的操作为?。
实验结束后,读出量气管中的气体体积(换算为标准状况),计算生铁样品中铁的质量分数,测定的结果偏低,可能的原因是?。(填字母序号)
A. 反应结束并冷却后,未再次调节量气管和水准管中液面相平, 即读取气体体积
B. 稀硫酸过量
C. 水准管中有少量水溢出
(2)设计如图乙所示装置,测得反应前后的有关质量如表,则生铁样品中铁的质量分数为?,根据图中装置判断,若实验中操作没有失误,该实验结果可能??。(填“偏大”、“偏小”或 “准确”)
反应前:整套装置+
稀硫酸质量/g
| 反应前:
生铁样品质量/g
| 反应后:整套装置+
锥形瓶中剩余物的质量/g
| a
| m
| b
|
(3)若取生铁粉末5.72 g,高温下的氧气流中充分反应,得到CO2气体224 mL(标准状况)。则此生铁粉末中铁和碳的物质的量之比为?。若再取三份不同质量的生铁粉末,分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示。计算实验Ⅱ结束后的溶液中,还能溶解生铁样品的质量?。
实验序号
| Ⅰ
| Ⅱ
| Ⅲ
| 加入生铁样品的质量/g
| 1.43
| 2.86
| 8.58
| 生成气体的体积/L(标准状况)
| 0.56
| 1.12
| 2.24
5、实验题 某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液。请完成对反应物剩余情况的探究。
(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:__________________。
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液。此澄清溶液中肯定含有的金属阳离子是___________。
(3)设计后续实验方案验证假设。请在答题卡上写出实验步骤以及预期现象和结论。 限选实验试剂:
3mol/L H2SO4、0. 01 mol/L KMnO4、20% KSCN、3% H2O2、淀粉-KI溶液、紫色石蕊溶液。

|
|