1、选择题 有NaHCO3、Na2CO3、CaO、NaOH组成的混合物13.6g,把它们溶于水后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应后的溶液蒸干,最后得到白色固体物质共14.5g,则原混合物中Na2CO3的质量是( )
A.10.6g
B.5.3g
C.5.9g
D.无法确定
参考答案:设原混合物中Na2CO3的质量为x
CaO+H2O=Ca(OH)2…(1)
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O …(2)
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH …(3)
(1)+(2)得:CaO+NaHCO3=CaCO3↓+NaOH …(4)
(1)+(3)得:CaO+H2O+Na2CO3=CaCO3↓+2NaOH …(5)
反应(4)即CaO 与NaHCO3 反应,不会引起固体质量增加
反应(5)即CaO 与Na2CO3 反应,由于H2O 参加反应,会引起固体质量增加.
即:固体增加的质量等于参加反应的水的质量.
因此,根据反应(5),有:
?H2O~~~Na2CO3
?18? 106
14.5g-13.6g? x
x=106×0.9g18
解得:x=5.3g
答:原混合物中Na2CO3的质量是5.3g.
本题解析:
本题难度:一般
2、选择题 下列离子方程式正确的是
A.向次氯酸钙溶液中通入过量CO2:Ca2++2ClO—+H2O+CO2=CaCO3↓+2HClO
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
C.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+
D.含等物质的量的NaHCO3和Ba(OH)2溶液混合: HCO+OH-+Ba2+ ===BaCO3↓+H2O
参考答案:D
本题解析:A选项,生成物应为碳酸氢钙,B选项是可逆反应,用可逆符号,C选项电荷不守恒。
本题难度:简单
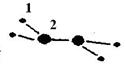
3、填空题 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图:??。
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是?(用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为?。
T/K
| 303
| 313
| 323
|
NH3生成量/(10—1mol)
| 4.3
| 5.9
| 6.0
|
?
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) 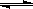 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq)
写出上述反应的平衡常数表达式?
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
实验①
| 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合
| 生成白色沉淀
|
实验②
| 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合
| 无现象
|
?
请分析实验①、②产生不同现象的原因:?。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
实验编号
| I—的初始浓度
(mol·L—1)
| ClO—的初始浓度
(mol·L—1)
| OH—的初始浓度
(mol·L—1)
| 初始速率v
(mol·L—1· s—1)
|
1
| 2 × 10—3
| 1.5 × 10—3
| 1.00
| 1.8 × 10—4
|
2
| a
| 1.5 × 10—3
| 1.00
| 3.6 × 10—4
|
3
| 2 × 10—3
| 3 × 10—3
| 2.00
| 1.8 × 10—4
|
4
| 4 × 10—3
| 3 × 10—3
| 1.00
| 7.2 × 10—4
|
?
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是?;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v=?。
参考答案:(1)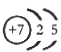 ? (2分)?(2)HSO3—+ Cl2 +H2O? = 3H+ + SO42—+ 2Cl-?(3分)
? (2分)?(2)HSO3—+ Cl2 +H2O? = 3H+ + SO42—+ 2Cl-?(3分)
(3)2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g)?△H=+1530.0kJ/mol?(3分)
(4)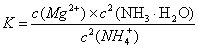 ?(2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
?(2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(5)①? ClO— 对反应速率的影响?(2分)
②? 7.2 × 10—4?(2分)
本题解析:(1)根据题意推断,M为N2H4,则1、2分别表示H、N,氮原子的核电荷数为+7,核外电子层结构为25;(2)亚硫酸盐与氯水发生氧化还原反应,生成强酸,反应式为HSO3—+Cl2+H2O=3H++SO42—+2Cl-;(3)读表可知,升高温度,平衡右移,说明正反应是吸热反应;根据原子守恒可知,1/2N2(g)+3/2H2O(l) NH3(g)+3/4O2(g)?△H=+382.5kJ/mol,或2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g)?△H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=
NH3(g)+3/4O2(g)?△H=+382.5kJ/mol,或2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g)?△H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=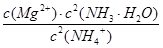 ;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v="7.2" × 10—4。
;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v="7.2" × 10—4。
本题难度:困难
4、选择题 同学们在讨论往碳酸氢铵溶液中滴加石灰水的离子反应时,提出了如下四种结论(用离子方程式形式表达),其中一定不合理的是
A.Ca2++2OH-+NH4++HCO3-→CaCO3↓+NH3?H2O+H2O
B.NH4++CO32-+Ca2++OH-→CaCO3↓+NH3?H2O
C.HCO3-+Ca2++OH-→CaCO3↓+H2O
D.2?HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32-
参考答案:BC
本题解析:分析:A、碳酸氢铵过量,氢氧化钙离子方程式中符合化学式组成比;
B、碳酸氢铵反应碳酸氢根离子是弱酸阴离子;
C、依据离子组成分析,氢氧根离子和碳酸氢根离子等物质的量反应,氢氧根离子会和铵根离子反应;
D、碳酸氢铵和氢氧化钙2:1反应时,氢氧根离子全部和碳酸氢根离子反应,铵根离子不反应.
解答:A、碳酸氢铵过量,氢氧化钙离子方程式中符合化学式组成比;Ca2++2OH-+NH4++HCO3-→CaCO3↓+NH3?H2O+H2O符合用量,故A正确;
B、碳酸氢铵反应碳酸氢根离子是弱酸阴离子不能茶城碳酸根离子,故B错误;
C、氢氧根离子和碳酸氢根离子等物质的量反应,氢氧根离子会和铵根离子反应,NH4++HCO3-+Ca2++2OH-→CaCO3↓+H2O+NH3?H2O,故C错误;
D、碳酸氢铵和氢氧化钙2:1反应时,氢氧根离子全部和碳酸氢根离子反应,反应离子方程式为:2 HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32-,故D正确;
故选BC.
点评:本题考查了离子方程式的书写方法和产物判断,离子反应顺序分析,题目难度较大.
本题难度:简单
5、选择题 常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为:①>②>③
B.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 KHC2O4溶液中:c(OH-)=c(H+) +c(H2C2O4)-2c(C2O42-)
D.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3)
参考答案:D
本题解析:试题分析: A、酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:CH3COONa<Na2CO3,pH均为9的三溶液,物质的量浓度CH3COONa最大、NaOH最小,错误;B、饱和氯水中加入氢氧化钠溶液至中性,c(ClO-)<c(Cl-),错误;C、KHC2O4溶液电荷守恒式为c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)、物料守恒式为c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),所以c(OH-)=c(H+) +c(H2C2O4)-c(C2O42-),错误。D、等浓度、等体积碳酸钠与碳酸氢钠溶液混合,电荷守恒式为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)、物料守恒式为2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)],消去c(Na+)得:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),因溶液呈碱性,c(OH-)>c(H+),所以c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3),正确。
考点: 离子浓度比较
本题难度:一般