1、选择题 下列说法正确的是
A.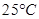 时
时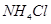 溶液的KW大于
溶液的KW大于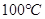 时
时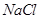 溶液的KW
溶液的KW
B.SO2通入碘水中,反应离子方程式为
C.加入铝粉能产生H2的溶液中,可能存在大量的
D.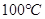 时,将pH=2的盐酸与pH=12的
时,将pH=2的盐酸与pH=12的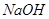 溶液等体积混合,溶液显中性
溶液等体积混合,溶液显中性
参考答案:C
本题解析:
正确答案:C
水的离子积常数只与温度有关,温度越高,Kw越大,A错;SO2通入碘水中生成SO42-,B错;加入铝粉能产生H2的溶液可能是强酸性溶液,也可能可能是强碱性溶液,在强酸性溶液中不可能存在AlO2―和NO3-,在强碱性溶液中,C中离子互不反应,可以大量共存,C正确;100℃时,Kw=1×10-12,所以将pH=2的盐酸与pH=12的NaOH溶液等体积混合后,溶液显碱性,D错;选C。
本题难度:一般
2、选择题 下列各组离子中,每个离子都能影响水的电离平衡的一组是 ( )
A.Zn2+、Ag+、HCO3-、Cl-、PO43-、SO42-
B.Fe3+、Br-、Al3+、H+、CO32-、H2PO4-
C.Ag+、SO32-、SiO32-、Fe2+、S2-
D.Fe2+、ClO-、OH-、HS-、Cu2+、HSO3-
参考答案:CD
本题解析:试题分析:在溶液中盐电离出的离子与水电离出的氢离子或氢氧根结合生成弱电解质的反应,称为盐类水解,这说明有弱才能发生水解反应,所以A中的Cl-、SO42-,B中的Br-、H+都不能水解,答案选CD。
考点:考查盐类水解的判断
点评:该题是基础性试题的考查,试题难易适中,注重基础知识的巩固,该题的关键是明确盐类水解的条件,然后灵活运用即可得出正确的结论。
本题难度:困难
3、填空题 有A 、B 、C 、D 四种化合物, 分别由K+、Ba2+、SO42-、CO32-、SO32-、OH-中的两种组成。它们具有下列性质:
① A 不溶于水和盐酸?
② B 不溶于水但溶于盐酸并放出无刺激性气味的气体
③ C 的水溶液呈碱性,与H2SO4反应生成A
④ D 可溶于水,与H2SO4作用时放出的气体E 可使溴水褪色。
试回答以下问题推断A ~E 的化学式:
A ._______ ;B ._______ ;C ._______ ;D .________ ;E .________ 。
参考答案:A﹕BaSO4;B﹕BaCO3;C﹕Ba(OH)2;D﹕ K2SO3;E﹕SO2
本题解析:
本题难度:一般
4、选择题 下列反应既是离子反应,又是氧化还原反应的是
A.二氧化硫气体与硫化氢气体作用生成硫和水
B.二氧化碳气体与氢氧化钠溶液作用生成碳酸钠和水
C.过氧化钠固体与二氧化碳气体反应生成碳酸钠和氧气
D.Zn粒与稀硫酸反应制取氢气
参考答案:D
本题解析:有离子参加的反应是离子反应,而凡是有元素化合价升降的反应都是氧化还原反应,所以选项D同时满足;选项A是氧化还原反应,但不是离子反应;选项B是离子反应,但不属于氧化还原反应;选项C是氧化还原反应,但不是离子反应,答案选D。
本题难度:一般
5、选择题 一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.碱性溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
参考答案:A
本题解析:B、Ca2+和SO42-、CO32-产生沉淀,不能共存
C、Fe3+与SCN-产络合物不能共存;
D、NO3-和H+具有强氧化性,将Fe2+氧化。
本题难度:简单