1、简答题 已知CH4、H2、和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1.
(1)用铂电极电解稀硫酸溶液,当阳极产生2.24L(标准状况)气体时需消耗的能量是(假设能量的利用率为80%)______.
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO(另一产物为H2),写出该反应的热化学方程式______;
(3)甲烷燃料电池是利用燃料甲烷跟氧气或空气反应,将化学能转化成电能的装置,电解质是强碱溶液.在甲烷燃料电池中:负极反应为______,放电时溶液中的阴离子向______极移动;随放电的进行,溶液的pH______(选填“增大”、“减小”或“不变”).若用该燃料电池电解氯化铜溶液,当消耗甲烷5.6L(标准状况)时,可生成铜的质量为(假设能量的利用率为100%)______.
参考答案:(1)用铂电极电解稀硫酸溶液,阳极生成O2,n(O2)=2.24L22.4L/mol=0.1mol,由氢气的燃烧热可知2H2O(l)=O2(g)+2H2(g)△H=+571.6kJ?mol?-1,则生成0.1mol需要O2吸收0.1mol×571.6kJ?mol?-1=57.16kJ,由于能量的利用率为80%,则实际应吸收51.76kJ80%=71.5kJ,故答案为:71.5kJ;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ?mol?-1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ?mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ?mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3?kJ?mol?-1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3?kJ?mol?-1;
(3)在甲烷燃料电池中负极甲烷发生氧化反应生成CO32-和H2O,负极电极反应式为CH4+10OH--8e═CO32-+7H2O,放电时溶液中的阴离子向负极,总反应式为CH4+2O2+2OH-═CO32-+3H2O,OH-浓度降低,则pH减小,当消耗甲烷5.6L(标准状况)时,转移电子的物质的量为5.6L22.4L/mol×8=2mol,则生成铜1mol,质量为64g,
故答案为:CH4+10OH--8e═CO32-+7H2O;负;减小;64g.
本题解析:
本题难度:一般
2、选择题 298K、10lkPa时,1molH2(g)与O2(g)完全反应生成H2O(g)时放出242kJ热量,而生成H2O(1)时放出286kJ热量,则下列表达不正确的是( )
A.2H2(g)+O2(g)=2H2O(g);△H=-484kJ?mol-1
B.H2O(g)=H2(g)+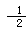 O2(g);△H=242kJ?mol-1
O2(g);△H=242kJ?mol-1
C.H2(g)+ O2(g)=H2O(1);△H=-286kJ?mol-1
O2(g)=H2O(1);△H=-286kJ?mol-1
D.H2O(1)=H2O(g);△H=-44kJ?mol-1
参考答案:D
本题解析:
本题难度:一般
3、填空题 依据事实,写出下列反应的热化学方程式。
(1)在25℃.101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________________________
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。
________________________________________
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。___________________________________
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ.391kJ.946kJ,则N2
与H2反应生成NH3的热化学方程式为______________________________
参考答案:(1)CH3OH(l)+3/2O2(g)→CO2(g)+2H2O(l);ΔH=-725.76kJ·mol-1
(2)N2(g)+2O2(g)==2NO2(g);ΔH=67.8kJ·mol-1
(3)C2H2(g)+5/2O2(g)→2CO2(g)+H2O(l);ΔH=-1300kJ·mol-1
(4)N2(g)+3H2(g)==2NH3(g);ΔH=-92kJ·mol-1
本题解析:
本题难度:一般
4、填空题 氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的核外电子的轨道表示式为 。
(2)N≡N的键能为942 kJ/mol,N-N单键的键能为247 kJ/mol,计算说明N2中
的 键比 键稳定(填“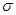 ”“
”“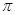 ”)。
”)。
(3)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式。
化学键
| N-N
| N=N
| N≡N
| N-H
| H-H
|
键能/kJ?mol-1
| 159
| 418
| 946
| 391
| 436
|
___ _____________________________。
参考答案:(9分)(1)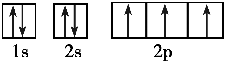
(2) 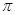
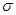 ( 每空2分)
( 每空2分)
(3 )N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol(3分)
本题解析:(1)根据构造原理可知,基态N3-的核外电子的轨道表示式是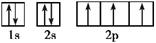 。
。
(2)三键是有1个 键和2个
键和2个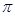 键构成的,则根据N≡N的键能为942 kJ/mol,N-N单键的键能为247 kJ/mol可知,
键构成的,则根据N≡N的键能为942 kJ/mol,N-N单键的键能为247 kJ/mol可知,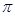 键键能是(942 kJ/mol-247 kJ/mol)÷2=347.5 kJ/mol>247 kJ/mol,所以N2中的
键键能是(942 kJ/mol-247 kJ/mol)÷2=347.5 kJ/mol>247 kJ/mol,所以N2中的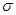 键比
键比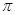 键稳定。
键稳定。
(3)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是△H=3×436 kJ/mol+942 kJ/mol-2×3×391kJ/mol=-92kJ/mol,即热化学方程式是N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol。
考点:考查轨道表达式、共价键以及反应热的计算和热化学方程式的书写
点评:该题是中等难度的试题,试题基础性强,在注重对吸收基础知识巩固和训练的同时,侧重对学生能力的培养,意在巩固学生的基础,提高学生的答题能力和学习效率。
本题难度:一般
5、选择题 下列有关热化学方程式的表示及说法正确的是( )
A.已知c(石墨,s)=c(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
C.HCl和NaOH反应的中和热为-57.3kJ/mol,则H2SO4和Ba(oH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知I2(g)+H2(g)═2HI(g)△H1;I2(s)+H2(g)═2HI(g)△H2;则△H1<△H2
参考答案:D
本题解析:
本题难度:一般