1、选择题 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)==CO(g) △H=-393.5kJ/mol
B.2H2(g)+O2(g)==2H2O(g) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890.3kJ/mol
D.1/2C6H12O6(s)+3O2(g)==3CO2(g)+3H2O(l) △H=-1400kJ/mol
2、填空题 (14分)I.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.5mol液态肼和1mol H2O2混合反应,生成氮气和水蒸气,放出256.5kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44.0kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
II.已知: (s,白磷)+
(s,白磷)+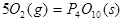
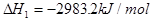
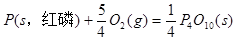
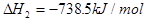
则白磷转化为红磷为____________反应(填“吸热”或“放热”);白磷的稳定性比红磷___________(填“高”或“低”)。
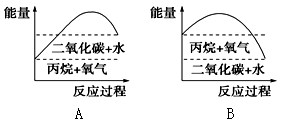
III.能较准确地反映丙烷燃烧时能量变化的曲线是________。
3、填空题 (12分)
(1)已知C(石墨,s)= C(金刚石,s);△H>0,则稳定性:金刚石 石墨(填>或<)
(2)已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2。则△H1 △H2(填>或<)
(3)“嫦娥五号”预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备. 用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g) △H="+10.7kJ·" mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H="-543" kJ· mol-1
写出气态肼和N2O4反应的热化学方程式为 。
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为△H= 。
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为△H=
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、
946 kJ,则N2与H2反应生成NH3的热化学方程式是 。
4、简答题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
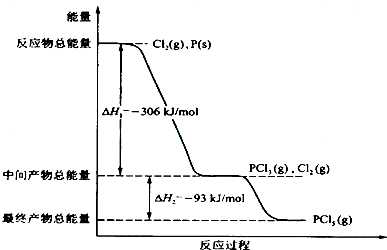
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______.
(2)PCl5分解成PCl3和Cl2的热化学方程式______,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2______α1(填“大于”、“小于”或“等于”).
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______.
(4)P和Cl2分两步反应生成1molPCl5的△H3=______.
5、选择题 0. 096 kg碳完全燃烧可放出3 134.4 kJ热量,以下对此反应的热化学方程式中书写正确的是?
[? ]
A.C(s) +O2(g)=CO2(g) △H=+391.8 kJ·mol-1
B.C(s)+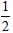 O2 (g)=CO( g) △H=-391.8kJ·mol-1
O2 (g)=CO( g) △H=-391.8kJ·mol-1
C.C(s)+O2(g) =CO2(g) △H = - 391.8 kJ·mol-1
D.C(s)+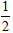 O2(g)=CO(g) △H=+391.8 kJ·mol-1
O2(g)=CO(g) △H=+391.8 kJ·mol-1