1、选择题 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)==CO(g) △H=-393.5kJ/mol
B.2H2(g)+O2(g)==2H2O(g) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890.3kJ/mol
D.1/2C6H12O6(s)+3O2(g)==3CO2(g)+3H2O(l) △H=-1400kJ/mol
参考答案:D
本题解析:
本题难度:一般
2、填空题 (14分)I.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.5mol液态肼和1mol H2O2混合反应,生成氮气和水蒸气,放出256.5kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44.0kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
II.已知: (s,白磷)+
(s,白磷)+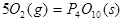
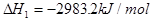
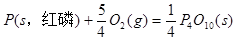
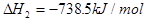
则白磷转化为红磷为____________反应(填“吸热”或“放热”);白磷的稳定性比红磷___________(填“高”或“低”)。
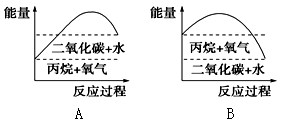
III.能较准确地反映丙烷燃烧时能量变化的曲线是________。
参考答案:I.(1)N2H4(l)+2H2O2(l) ="=" N2(g) +4H2O(g) △H=-513.0KJ/mol (2)344.5
(3)产物不会造成环境污染。 II. 放热;低. III. B
本题解析:
试题解析:(1)解:液态肼和H2O2混合反应,反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出akJ的热量,则1mol液态肼放出的热量为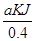 =
=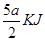 ,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-
,所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-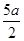 kJ/mol;(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-
kJ/mol;(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-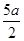 kJ/mol;②H2O(l)=H2O(g)△H=+bkJ/mol,
kJ/mol;②H2O(l)=H2O(g)△H=+bkJ/mol,
依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)
本题难度:一般
3、填空题 (12分)
(1)已知C(石墨,s)= C(金刚石,s);△H>0,则稳定性:金刚石 石墨(填>或<)
(2)已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2。则△H1 △H2(填>或<)
(3)“嫦娥五号”预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备. 用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g) △H="+10.7kJ·" mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H="-543" kJ· mol-1
写出气态肼和N2O4反应的热化学方程式为 。
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为△H= 。
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为△H=
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、
946 kJ,则N2与H2反应生成NH3的热化学方程式是 。
参考答案:(12分,每空2分) (1)< (2) < (3) 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=—1096.7kJ· mol-1
(4)-282.6kJ· mol-1 (5)-57.3kJ· mol-1 (6)N2(g)+3H2(g)=2NH3(g)△H=-92kJ· mol-1
本题解析:(1)已知C(石墨,s)= C(金刚石,s);△H>0,这说明该反应是吸热反应,因此石墨的总能量低于金刚石。能量越低越稳定,则稳定性金刚石 <石墨。
(2)碳完全燃烧放热多,但放热越多△H越小。因此如果2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 。
(3)已知:①N2(g)+2O2(g)=N2O4(g) △H="+10.7kJ·" mol-1,②N2H4(g)+O2(g)=N2(g)+2H20(g) △H="-543" kJ· mol-1,则根据盖斯定律可知②×2—①即顶点气态肼和N2O4反应的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=—1096.7kJ· mol-1。
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则1molCO即28gCO完全燃烧放出的热量是282.6kJ。由于燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则CO的燃烧热为△H=-282.6kJ· mol-1。
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,反应中生成2mol水。又因为中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的中和热为△H=-57.3kJ· mol-1 。
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、946 kJ,又因为反应热等于断键吸收的热量与形成化学键所放出的热量的差值,则N2与H2反应生成2molNH3的燃烧热是436kJ/mol×3+946kJ/mol-391kJ/mol×3×2=—92kJ/mol、则该反应的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92kJ· mol-1。
考点:考查反应热的有关计算与应用、盖斯定律、燃烧热、中和热等
本题难度:一般
4、简答题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
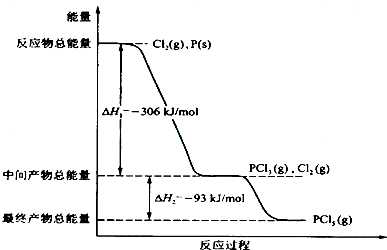
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______.
(2)PCl5分解成PCl3和Cl2的热化学方程式______,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2______α1(填“大于”、“小于”或“等于”).
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______.
(4)P和Cl2分两步反应生成1molPCl5的△H3=______.
参考答案:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为:P(s)+32Cl2(g)═PCl3(g);△H=-306 kJ/mol,
故答案为:P(s)+32Cl2(g)═PCl3(g);△H=-306kJ?mol-1;?
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol,
PCl5分解率α1=0.8mol-0.6mol0.8mol×100%=25%.PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,α2 >α1 ;
故答案为:PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1;25%;大于;?
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
P(s)+32Cl2(g)=PCl3(g);△H1=-306 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,
故答案为:-399kJ?mol-1.
本题解析:
本题难度:一般
5、选择题 0. 096 kg碳完全燃烧可放出3 134.4 kJ热量,以下对此反应的热化学方程式中书写正确的是?
[? ]
A.C(s) +O2(g)=CO2(g) △H=+391.8 kJ·mol-1
B.C(s)+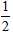 O2 (g)=CO( g) △H=-391.8kJ·mol-1
O2 (g)=CO( g) △H=-391.8kJ·mol-1
C.C(s)+O2(g) =CO2(g) △H = - 391.8 kJ·mol-1
D.C(s)+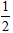 O2(g)=CO(g) △H=+391.8 kJ·mol-1
O2(g)=CO(g) △H=+391.8 kJ·mol-1
参考答案:C
本题解析:
本题难度:一般