1、填空题 某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
物质
| FeSO4
| H2SO4
| Ag2SO4
| Al2(SO4)2
| 污泥
|
质量分数/(%)
| 15.0
| 7.0
| 0.40
| 0.34
| 5.0
|
表二? FeSO4和Al2(SO4)3在水中的溶解度
温度/℃
| 0
| 10
| 20
| 30
| 40
| 50
|
FeSO4溶液度(g)
| 15.6
| 20.5
| 26.5
| 32.9
| 40.2
| 48.6
|
Al2(SO4)3溶解度(g)
| 31.2
| 33.5
| 36.4
| 40.4
| 45.7
| 52.2
|
?该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是?。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③?,目的是使Ag+全部还原为金属Ag;
④?,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第?步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后,?,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式?。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是?。
参考答案:(1)① 洗去油污 (1分) ③ 在②的滤液中加入稍过量的洗涤过的废铁屑(1分),
充分反应后过滤(1分)
④ 将③的滤渣溶入足量的稀硫酸(1分),过滤,滤液保留待用(1分)
(2)⑤③ (2分)将溶液加热(温度不超过80℃)蒸发浓缩(1分),冷却结晶(1分)
(3)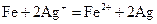 ,
, 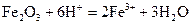 ,
,
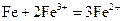 ,
, 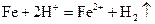 (4分)
(4分)
(4)抑制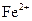 的水解(防止
的水解(防止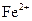 被氧化)(2分)
被氧化)(2分)
本题解析:略
本题难度:一般
2、选择题 某同学将一小块金属钠和一块铁片分别放在表面皿中,研究它们在空气中的稳定性。该学生采用的研究方法是
[? ]
①假说法 ②实验法 ③分类法 ④比较法
A.① ②
B.① ③
C.② ④
D.② ③
参考答案:C
本题解析:
本题难度:简单
3、选择题 可以证明次氯酸是弱酸的事实是( )
A.可与碱反应
B.有漂白性
C.见光能分解
D.次氯酸钙溶液可与碳酸反应生成次氯酸
参考答案:D
本题解析:
本题难度:一般
4、填空题 (10分)某研究性学习小组对铝热反应实验 展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学
展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学 手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质
| Al
| Al2O3
| Fe
| Fe2O3
|
熔点/℃
| ? 660?
| 2054
| 1535
| 1462
|
沸点/℃
| 2467
| 2980
| 2750
| -
|
I.?⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试是_______________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________ (填序号)。
(填序号)。
A.浓硫酸? B.稀硫酸? C.稀硝酸? D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
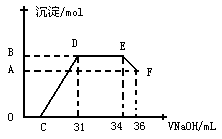
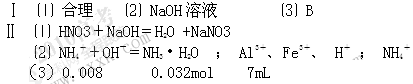
⑴图中OC段没有沉淀生成,此阶段发生反应的化学方程式为__________________________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式是
_______________?_______;
上述现象说明溶液中________?_________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点 对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
参考答案:
本题解析:略
本题难度:简单
5、实验题 文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究:
(1) 提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有?。
(2) 设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
实验步骤
| 预期现象和结论
|
步骤1:取适量酸雨于A、B两支洁净试管中,待用。
| ?
|
步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤。
| ?
|
步骤3:取少量步骤2得到的滤渣加入足量的盐酸。
| ?
|
步骤4:取少量步骤2得到的的滤液,加入?
?。
| ?
?
|
步骤5:往B试管中加入?
?。
| ?
?
参考答案:(12分)(1)SO2(或H2SO3)(2分)
(2)每空2分
实验步骤
预期现象和结论
步骤3:
若滤渣不完全溶解则酸雨中含有硫酸
步骤4:取少量步骤2得到的的滤液,加入过量的硝酸银,然后加入少量的硝酸银溶液
若产生白色沉淀,则酸雨中含有盐酸
步骤5:往B试管中加入几滴品红溶液,振荡
若品红溶液褪色,则所以中含有亚硫酸或SO2
本题解析:(1)由于酸雨中硫酸是亚硫酸被氧化后生成的,所以 主要溶质还一定有亚硫酸或SO2。
(2)由于硫酸钡和亚硫酸钡都是不溶于水的白色沉淀,但硫酸钡还不能溶于酸中,所以步骤3中,预期的现象和结论应该是:若滤渣不完全溶解则酸雨中含有硫酸;氯离子的检验一般用硝酸酸化的硝酸银溶液,所以步骤4应该是:取少量步骤2得到的的滤液,加入过量的硝酸银,然后加入少量的硝酸银溶液。预期的现象和结论应该是:若产生白色沉淀,则酸雨中含有盐酸。SO2的检验一般用品红溶液,所以步骤5应该是:往B试管中加入几滴品红溶液,振荡。预期的现象和结论应该是:若品红溶液褪色,则所以中含有亚硫酸或SO2。
点评:该题是高考中的常见考点,属于中等难度的试题。试题难易适中,侧重对学生基础性知识的巩固与训练,有助于培养学生综合实验能力和规范严谨的实验实际能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
|